“ Wie groß ist eine E. coli-Zelle und wie groß ist ihre Masse?
On Dezember 3, 2021 by adminWie groß ist eine E. coli-Zelle und wie groß ist ihre Masse?
Lesemodus
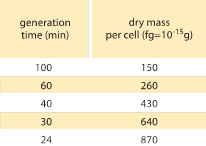
Tabelle 1: Verhältnis zwischen Bakterienmasse und Teilungszeit. Die Trockenmasse pro Zelle ist in Abhängigkeit von der Generationszeit (Verdopplungszeit) angegeben. Es wird angenommen, dass die Masse ungefähr exponentiell mit der Wachstumsrate zunimmt, wie ursprünglich von M. Schaechter et al. beobachtet (J. Gen. Microbiol., 19:592, 1958). Das Zelltrockengewicht wurde unter Verwendung eines Wertes von 173 µg pro OD460-Einheit von einem mL (BNID 106437) berechnet. Der verwendete Stamm ist B/r, ein Stamm, der häufig in frühen Studien zur Bakterienphysiologie verwendet wird. Werte entnommen aus F. C. Neidhardt, „Escherichia coli and Salmonella: Cellular and Molecular Biology“, Vol. 1, Chapter 3, ASM Press, 1996.
Die Größe eines typischen Bakteriums wie E. coli dient als praktischer Standardmaßstab zur Charakterisierung von Längenskalen in der Molekular- und Zellbiologie. Eine „Faustregel“, die auf Generationen von licht- und elektronenmikroskopischen Messungen für die Abmessungen einer E. coli-Zelle beruht, besagt, dass sie einen Durchmesser von etwa ≈1µm, eine Länge von ≈2µm und ein Volumen von ≈1µm3 (1 fL) hat (BNID 101788). Die Form kann als Sphärozylinder, d. h. als Zylinder mit halbkugelförmigen Kappen, angenähert werden. Anhand des angegebenen Durchmessers und der Länge können wir eine genauere Schätzung des Volumens von ≈1,3 µm3 (5π/12, um genau zu sein) errechnen. Die Differenz zwischen diesem Wert und dem oben genannten Wert der Faustregel zeigt, mit welchem Maß an Inkonsistenz wir bei der Verwendung von Faustregeln gut leben können. Einer der einfachsten Wege zur Schätzung der Masse eines Bakteriums besteht darin, das ≈1 µm3 große Volumen einer E. coli-Zelle auszunutzen und anzunehmen, dass sie die gleiche Dichte wie Wasser hat. Diese naive Schätzung führt zu einem anderen Standardwert, nämlich, dass ein Bakterium wie E. coli eine Masse von ≈1 pg (pico=10-12) hat. Da die meisten Zellen zu etwa 2/3 aus Wasser bestehen (BNID 100044, 105482) und die anderen Bestandteile, wie z. B. Proteine, eine charakteristische Dichte von etwa dem 1,3-fachen der Dichte von Wasser haben (BNID 101502, 104272), ist die Umrechnung von Zellvolumen in Masse auf etwa 10 % genau.
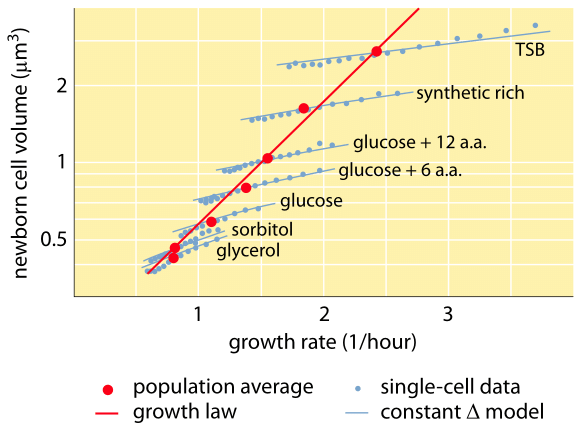
Abb. 1: Verhältnis zwischen Zellvolumen und Wachstumsrate. Mit Hilfe der Mikroskopie und mikrofluidischer Geräte kann das Zellvolumen auf der Ebene der einzelnen Zelle unter verschiedenen Bedingungen gemessen werden, was bestätigt, dass das durchschnittliche Zellvolumen exponentiell mit der Wachstumsrate wächst. Im Gegensatz dazu skaliert die Variation zwischen den Zellen unter einer bestimmten Bedingung unterschiedlich. Die Variation im Verhalten einzelner Zellen wird genutzt, um Modelle zur Regulierung der Zellgröße zu testen. (Adaptiert von S. Taheri-Araghi et al., Curr. Biol. 25:385, 2015.)
Eines der klassischen Ergebnisse der bakteriellen Physiologie betont, dass die Plastizität der Eigenschaften von Zellen auf die Abhängigkeit der Zellmasse von der Wachstumsrate zurückzuführen ist. Einfach ausgedrückt: Schnellere Wachstumsraten gehen mit größeren Zellen einher. Diese Beobachtung bezieht sich auf physiologische Veränderungen, bei denen Medien, die die Wachstumsrate erhöhen, auch zu größeren Zellen führen, wie in Abbildung 1 dargestellt. Dies wurde auch in der Genetik festgestellt, wo langfristige experimentelle Evolutionsstudien, die zu schnelleren Wachstumsraten führten, größere Zellvolumina ergaben (BNID 110462). Solche Beobachtungen helfen uns, mit dem Mythos „der Zelle“ aufzuräumen, bei dem man, oft unvorsichtigerweise, Messungen an einer Zelle verwendet, um Rückschlüsse auf andere Zelltypen oder denselben Zelltyp unter anderen Bedingungen zu ziehen. In den klassischen Studien von Dennis und Bremer wurden diese Messungen systematisiert und es wurde festgestellt, dass die Trockenmasse wie in Tabelle 1 dargestellt von einem Durchschnittswert von 148 fg für Zellen, die sich alle 100 Minuten teilen, bis zu 865 fg für Zellen mit einer Teilungszeit von 24 Minuten variiert, was einen Unterschied von mehr als dem Fünffachen in Abhängigkeit von der Wachstumsrate bedeutet. Ein ähnlicher Trend wurde auch bei anderen Organismen festgestellt (z. B. bei der Hefe, BNID 105103). Bei etwa 70 % Wasser entsprechen diese Werte einem Volumenbereich von etwa 0,4 bis 2,5 µm3. Wie lassen sich die größeren Größen für Zellen erklären, die mit höherer Geschwindigkeit wachsen? Diese Frage wird bis heute diskutiert (Molenaar D. et al. MSB 5:323, 2009; Amir, A., Phys. Rev, Let., 112:208102, 2014). Die Erklärungen reichen von der Annahme, dass es einen Vorteil bei der Ressourcenverteilung gibt, bis hin zu der Behauptung, dass es sich nur um einen Nebeneffekt der eingebauten Zeitspanne von etwa 60 Minuten handelt, die zwischen dem Zeitpunkt, an dem eine Zelle entscheidet, dass sie genug Masse angesammelt hat, um mit den Vorbereitungen für die Teilung zu beginnen, und dem Abschluss der DNA-Replikation und des Teilungsakts vergeht. Diese ungefähr konstante „Verzögerungszeit“ führt zu einer exponentiellen Abhängigkeit der durchschnittlichen Zellmasse von der Wachstumsrate in dieser Argumentation (Amir, A., Phys. Rev, Let.., 112:208102, 2014).
Methoden zur Messung des Zellvolumens reichen von der Verwendung eines Coulter-Zählers (BNID 100004), der das Volumen auf der Grundlage von Änderungen des Widerstands einer kleinen Öffnung ableitet, wenn eine Zelle diese passiert, bis hin zu direkteren Messungen unter Verwendung der Fluoreszenzmikroskopie, die die Länge und den Durchmesser der Zellen unter verschiedenen Bedingungen misst (Abbildung 1 und BNID 106577, 111480). Überraschenderweise kann die Tatsache, dass verschiedene Labors nicht immer zu den gleichen Werten konvergieren, auf Unterschiede in den Kalibrierungsmethoden oder den genauen Stämmen und Wachstumsbedingungen zurückzuführen sein. Eine noch nie dagewesene Möglichkeit zur Messung der Zellmasse wird durch das effektive Wiegen von Zellen auf einem mikroskopischen Ausleger erreicht. Wie in Abbildung 2A dargestellt, wird eine Zelle mit Hilfe eines Flüssigkeitsstroms in dem ausgehöhlten Ausleger hin- und herbewegt. Bei der Messung wird die Tatsache ausgenutzt, dass die Zellmasse die Schwingungsfrequenz des Cantilevers beeinflusst. Diese Frequenz kann mit einer phänomenalen Genauigkeit gemessen und zur Ableitung von Massen mit Femtogramm-Genauigkeit verwendet werden. Durch Änderung der Strömungsrichtung der Flüssigkeit wird die Zelle minutenlang oder länger eingeschlossen, und ihre Massenakkumulationsrate wird kontinuierlich auf Einzelzellniveau gemessen. Bei der ersten Anwendung dieser Technik zeigte sich, dass einzelne Zellen, die größer sind, auch schneller Masse ansammeln, was Licht auf eine seit langem bestehende Frage wirft: Ist das Zellwachstum linear mit der Zeit oder wird es eher durch einen annähernd exponentiellen Trend beschrieben? Die Unterschiede können winzig sein, aber mit diesen revolutionären Möglichkeiten wurde deutlich, dass das letztere Szenario die Situation bei mehreren getesteten Zelltypen besser wiedergibt, wie in Abbildung 2B zu sehen ist.
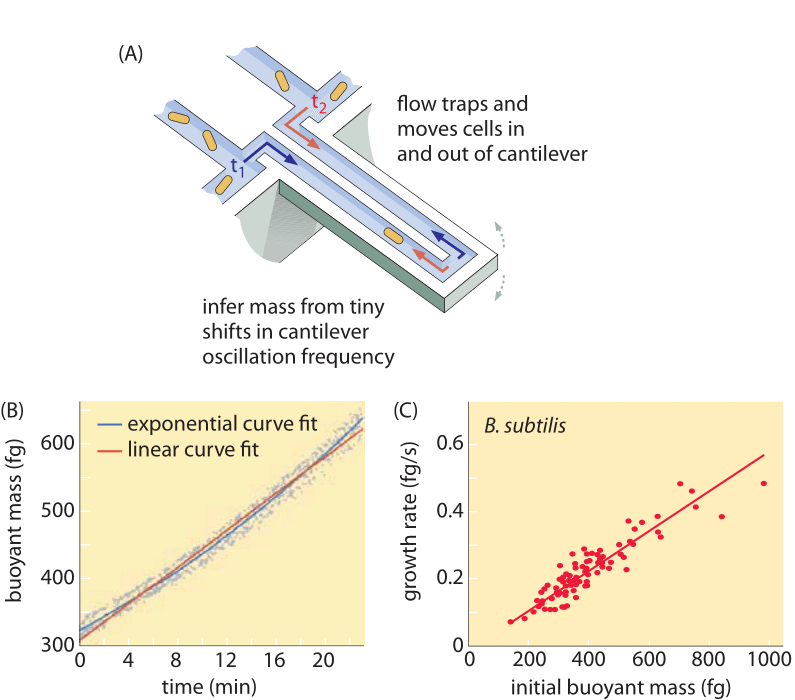
Abb. 2: Verwendung der Auftriebsmasse zur Messung des Wachstums einzelner Zellen. (A) Ein mikrometergroßer Ausleger schwingt mit hoher Frequenz, und die Masse der Zellen kann anhand von Änderungen der Schwingungsfrequenz bestimmt werden. (B) Über die Zeit gemessen, ergibt sich daraus eine Akkumulationskurve für die Masse einer einzelnen Zelle (siehe Abbildung). (C) Abgebildet sind hier B. subtilis-Zellen. Ein Vergleich zwischen den Vorhersagen des linearen und des exponentiellen Wachstumsmodells ist als beste Anpassung dargestellt. Die Ähnlichkeit zeigt, wie nahe sich die beiden Modelle über einen Bereich von nur einer zweifachen Zunahme im Verlauf des Zellzyklus sind. Das Trockengewicht der Zelle entspricht etwa dem 4-fachen der Auftriebsmasse. (Angepasst von M. Godin et al., Nature Meth. 7:387, 2010.)





Schreibe einen Kommentar