Sterische Hinderung
On Oktober 3, 2021 by adminSterische Hinderung an einem bestimmten Atom in einem Molekül ist die durch die physische Anwesenheit der umgebenden Liganden verursachte Stauung, die Reaktionen an dem Atom verlangsamen oder verhindern kann.
z.B.. 1:

In 1 ist der Carbonylkohlenstoff an zwei Wasserstoffatome gebunden. In 2 ist es an ein Wasserstoffatom und eine Methylgruppe gebunden. Da die Methylgruppe größer ist als das Wasserstoffatom, ist die sterische Hinderung am Carbonylkohlenstoff in 2 größer als in 1.
eg. 2:

In 1 ist das Stickstoffatom an drei Wasserstoffatome gebunden, in 2 ist es an drei Methylgruppen gebunden. Eine Methylgruppe ist größer als ein Wasserstoffatom. Daher ist die sterische Hinderung am Stickstoffatom in 2 größer als in 1.
eg. 3:
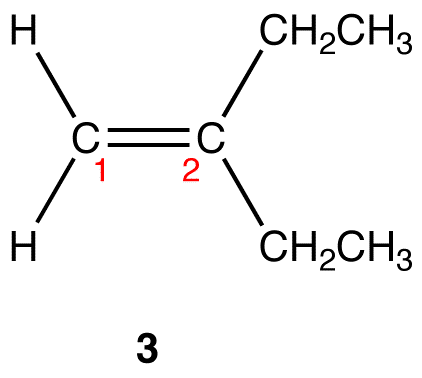
In 3 ist C1 doppelt an ein Kohlenstoffatom und einfach an zwei Wasserstoffatome gebunden, während C2 doppelt an ein Kohlenstoffatom und einfach an zwei Ethylgruppen gebunden ist. Eine Ethylgruppe ist größer als ein Wasserstoffatom. Daher ist die sterische Hinderung an C2 größer als die an C1.
- Siehe auch sterische Belastung
Beitragende und Zuschreibungen
- Gamini Gunawardena von der OChemPal-Site (Utah Valley University)
Schreibe einen Kommentar