Reaktionen am „benzylischen“ Kohlenstoff: Bromierung und Oxidation
On Oktober 12, 2021 by adminDer an einen aromatischen Ring angrenzende Kohlenstoff – der „benzylische“ Kohlenstoff – kann an mehreren nützlichen und interessanten Reaktionen teilnehmen. Heute werden wir Beispiele und Mechanismen für zwei wichtige Beispiele vorstellen: die benzylische Bromierung und die benzylische Oxidation. Hier ist die kurze Zusammenfassung:
Inhaltsverzeichnis
- Alkylgruppen = „Roughage“
- Es gibt etwas Besonderes bei Alkylgruppen, die an einen Benzolring angrenzen
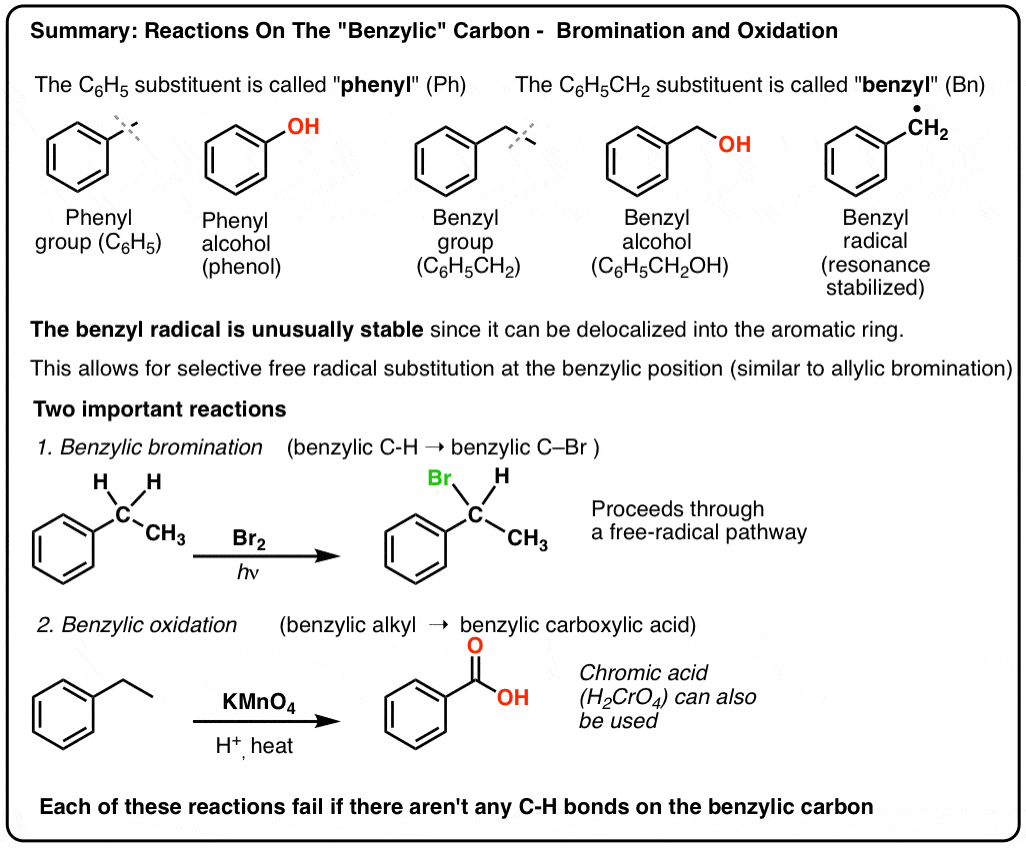
- „Phenyl“ vs „Benzyl“ : Was ist der Unterschied?
- Benzyl-Radikale werden durch Resonanz stabilisiert; Phenyl-Radikale nicht.
- Benzylische (und allylische) C-H-Bindungen sind schwach im Vergleich zu anderen Alkyl-C-H-Bindungen
- Benzyl-Bromierung
- Wann funktioniert „Benzyl-Bromierung“ nicht?
- Anwendungen der benzylischen Bromierung
- Benzylische Oxidation mit KMnO4 (oder H2CrO4)
- Benzylische Oxidation erfordert eine benzylische C-H-Bindung
- Warum ist das wichtig?
- Hinweise
- Quiz yourself!
- (Fortgeschrittene) Referenzen und weiterführende Literatur
Alkylgruppen = „Ballaststoffe“
In der Ernährung bezeichnet man als „Ballaststoffe“ all die Zellulose und Ballaststoffe, die in Lebensmitteln enthalten sind, die einfach durch den Körper schießen, ohne verdaut zu werden.
Das beschreibt ziemlich genau das Verhalten von Alkylgruppen in den meisten Reaktionen der organischen Chemie, die wir gelernt haben. Ihre Chemie ist „langweilig“. Sie bilden zwar das Rückgrat und die Gesamtstruktur des Moleküls, aber ihre C-H-Bindungen sind gegenüber den meisten Reaktionsbedingungen inert.
Wenn man die Verbrennung nicht mitzählt, ist so ziemlich die einzige Reaktion von Alkylgruppen, die wir in der Einführung in die organische Chemie behandeln, die radikalische Substitution. Und selbst diese Reaktion ist ziemlich unselektiv, vor allem, wenn es sich um die radikalische Chlorierung handelt.
Wir haben gesehen, dass eine Ausnahme von diesem „langweiligen“ Verhalten bei der radikalischen Bromierung von so genannten „allylischen“ C-H-Bindungen zu finden ist. Die „allylische“ Position ist ein Kohlenstoff, der an eine Doppelbindung angrenzt (nicht ein C-H an der Doppelbindung selbst! das ist ein „vinylic“ C-H).
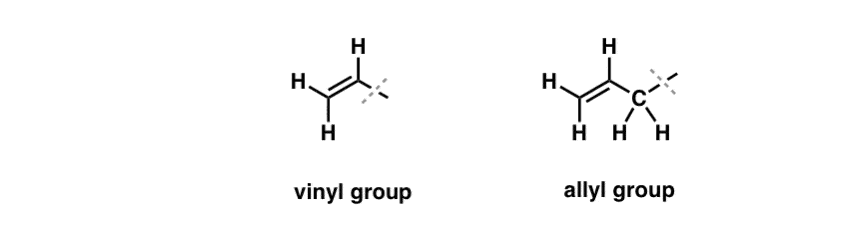
Was macht die „allylische“ Position so besonders? Allylische Radikale, Carbokationen und Anionen werden durch Resonanz erheblich stabilisiert. Das Orbital des allylischen Radikals, Carbokations oder Anions kann sich mit den p-Orbitalen in der benachbarten pi-Bindung ausrichten, wodurch ein größeres „pi-System“ entsteht und die Ladung auf eine größere Fläche verteilt wird.
Alkylgruppen, die an einen Benzolring angrenzen, sind etwas Besonderes
Was ist der Grund für diesen kleinen Ausflug in die Vergangenheit? Nun, wir haben kürzlich eine Weile damit verbracht, die Friedel-Crafts-Alkylierungsreaktion durchzugehen, und ich möchte Ihnen nicht den Eindruck vermitteln, dass das Anhängen einer Alkylgruppe an einen Benzolring eine synthetische Sackgasse ist.
Alkylgruppen müssen nicht träge sein! Wie Allylkohlenstoffe sind auch Alkylgruppen, die an Benzolringe angrenzen, besonders reaktiv, und das kann zu allerlei wichtigen Anwendungen führen.
Es gibt zwei wichtige Reaktionen, die wir in diesem Beitrag behandeln werden:
- Benzylische Bromierung – radikalische Bromierung der Alkylgruppe, die an einen aromatischen Ring angrenzt
- Benzylische Oxidation – vollständige Oxidation einer Alkylgruppe, die an Benzol angrenzt, zu einer Carbonsäure.
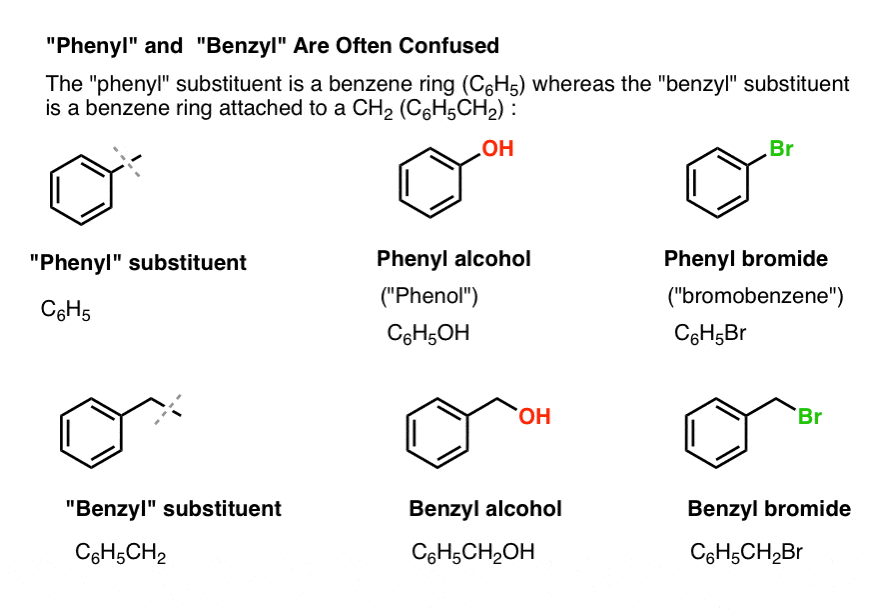
3. „Phenyl“ vs „Benzyl“ : What’s The Difference?
Zunächst eine kurze Erläuterung. Lassen Sie uns einige wichtige Nomenklaturen aus dem Weg räumen, denn „Phenyl“ und „Benzyl“ sorgen für viel Verwirrung:
- Eine Phenylgruppe (oder ein Phenylsubstituent) ist Benzol ohne einen Wasserstoff: C6H5 . Die Kohlenstoffe im Ring sind Phenylkohlenstoffe, und die an die Phenylkohlenstoffe gebundenen Wasserstoffe sind Phenyl-C-H-Bindungen. Es ist analog zu Vinyl (siehe oben).
- Eine Benzylgruppe ist Methylbenzol minus ein Wasserstoffatom: C6H5CH2 . Der an den Ring angrenzende Kohlenstoff ist das Benzylkohlenstoffatom, und die an das Benzylkohlenstoffatom gebundenen Wasserstoffatome werden Benzylwasserstoffe genannt. Es ist analog zu Allyl (oben).
4. Benzyl-Radikale werden durch Resonanz stabilisiert; Phenyl-Radikale nicht.
Die Analogie von Phenyl mit Vinyl und Benzyl mit Allyl erstreckt sich auch auf die Stabilität ihrer Radikale (sowie ihrer Carbokationen und Anionen).
- Phenylradikale werden nicht durch Resonanz stabilisiert, da das Orbital, in dem sich das Radikal befindet, rechtwinklig zu den Orbitalen des pi-Systems steht und es keine Überlappung zwischen ihnen gibt. Radikale an sp2-hybridisierten Kohlenstoffen sind im Allgemeinen weniger stabil als Radikale an Alkylkohlenstoffen. (Siehe Beitrag: Drei Faktoren, die freie Radikale destabilisieren)
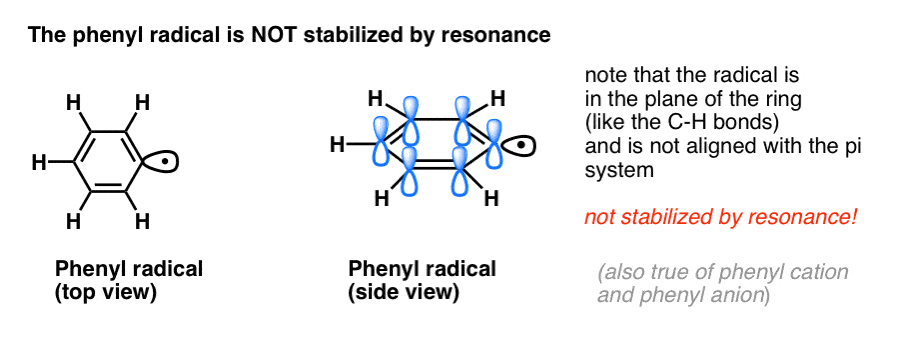
- Benzylradikale sind ungewöhnlich stabil, da sich das Orbital, in dem sich das Radikal befindet, mit dem pi-System des Benzolrings ausrichten kann, genau wie bei ihren allylischen Cousins (dies gilt auch für Benzylkationen und -anionen).
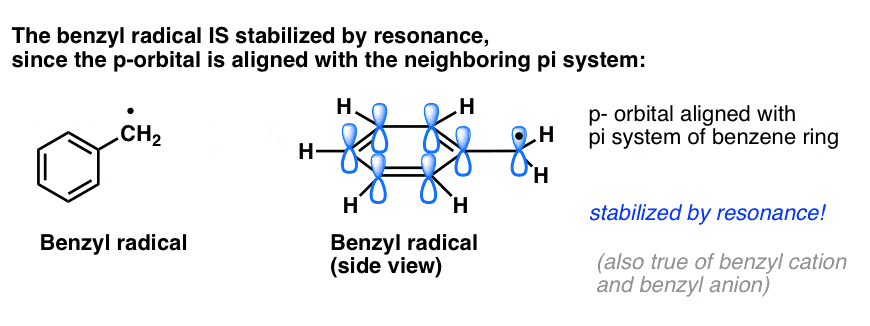
Benzylische (und allylische) C-H-Bindungen sind schwach, relativ zu anderen Alkyl-C-H-Bindungen
Benzylische C-H-Bindungen haben Bindungsstärken (auch BDE’s, oder Bindungsdissoziationsenergien) von etwa 90 kcal/mol, was erheblich schwächer ist als tertiäre C-H-Bindungen (Bindungsstärke 93 kcal/mol), sekundäre C-H-Bindungen (96 kcal/mol) und primäre C-H-Bindungen (100 kcal/mol). (Phenyl-C-H-Bindungen haben eine Stärke von etwa 113 kcal/mol, was wiederum die Instabilität von Phenylradikalen widerspiegelt).
Da die Bindungsdissoziationsenergien die Leichtigkeit der homolytischen Spaltung der C-H-Bindung widerspiegeln (d. h. wie leicht es ist, die Bindung in zwei freie Radikale zu dissoziieren), ist dies eine andere Art zu sagen, dass Benzylradikale im Vergleich zu anderen Alkylradikalen besonders leicht zu bilden sind.
Wir haben bereits gesehen, dass dies auch für allylische C-H-Bindungen gilt. Bei der „allylischen Bromierung“ wird eine der C-H-Bindungen an der Alkylgruppe, die einer Doppelbindung benachbart ist, unter Verwendung von N-Bromsuccinimid (NBS) und Licht (hν) in eine C-Br-Bindung umgewandelt:
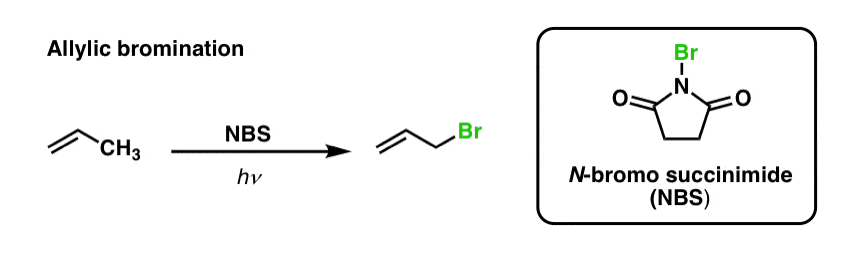
Die Reaktion ist selektiv für allylische C-H in Gegenwart von primären, sekundären und tertiären C-H-Bindungen aufgrund der schwächeren allylischen C-H-Bindungsstärke (89 kcal/mol).
Benzylische Bromierung
Ein ähnliches Verfahren funktioniert für „benzylische“ Kohlenstoffe. Wir können NBS (wie oben) oder einfach nur Br2 verwenden, da aromatische Ringe mit Br2 nicht annähernd so reaktiv sind wie Doppelbindungen.
Nach der Bildung (durch „Hitze“ oder „Licht“, die die Reaktion durch homolytische Dissoziation von Br-Br auslösen) kann das Bromradikal Br- die schwächeren benzylischen C-H-Bindungen brechen, ohne die stärkeren Alkyl-C-H-Bindungen zu berühren.
Zum Beispiel sind hier die Produkte seiner Reaktion mit Toluol und auch Isopropylbenzol. Man beachte, dass NUR der benzylische Kohlenstoff bromiert wird. Alles andere wird in Ruhe gelassen!
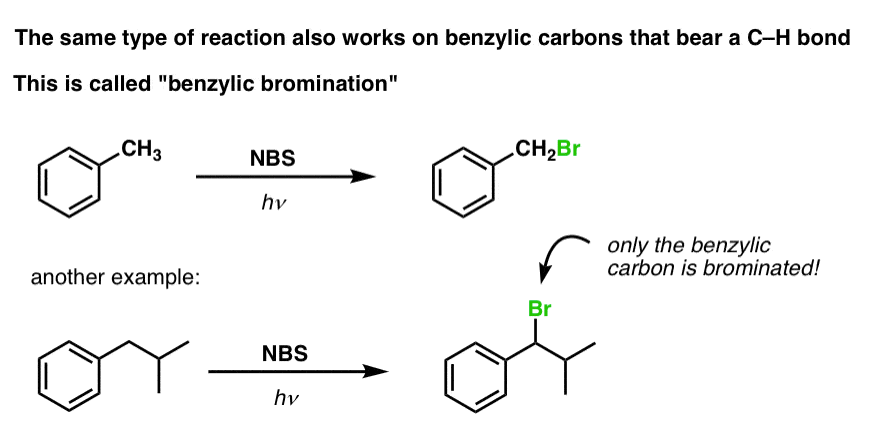
Der Mechanismus der benzylischen Bromierung ist im Wesentlichen identisch mit der allylischen Bromierung, mit Initiierungs-, Fortpflanzungs- und Abbruchschritten. (Klicken Sie hier, um ein Pop-up-Bild des Mechanismus zu sehen.)
(Weitere Informationen finden Sie in diesem Beitrag: Allylische Bromierung )
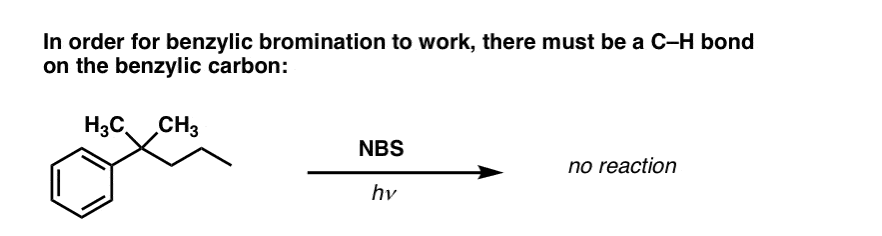
Wann funktioniert die „benzylische Bromierung“ NICHT?
Da der Schlüssel zu dieser Reaktion die Bildung des (relativ stabilen) Benzylradikals ist, wird die benzylische Bromierung bei Substraten scheitern, bei denen die Erzeugung dieses Radikals durch Aufbrechen einer C-H-Bindung unmöglich ist.
Betrachten Sie zum Beispiel das folgende Beispiel. Wie kann ein benzylisches Radikal erzeugt werden, wenn der benzylische Kohlenstoff drei Alkylgruppen trägt? Es geht nicht – und die Reaktion scheitert.
Anwendungen der benzylischen Bromierung
Warum also könnte die benzylische Bromierung nützlich sein?
Nun, sie erlaubt uns, alle Reaktionen von Alkylhalogeniden, die wir in Org 1 behandelt haben – hauptsächlich Substitution und Eliminierung – anzuwenden, um Produkte zu erhalten, die schwierig direkt an einem aromatischen Ring durch Friedel-Crafts-Reaktionen zu installieren wären.
Zum Beispiel kann die Benzylbromierung verwendet werden, um eine SN2-Reaktion einzuleiten, z.B. nach einer Friedel-Crafts-Alkylierung:
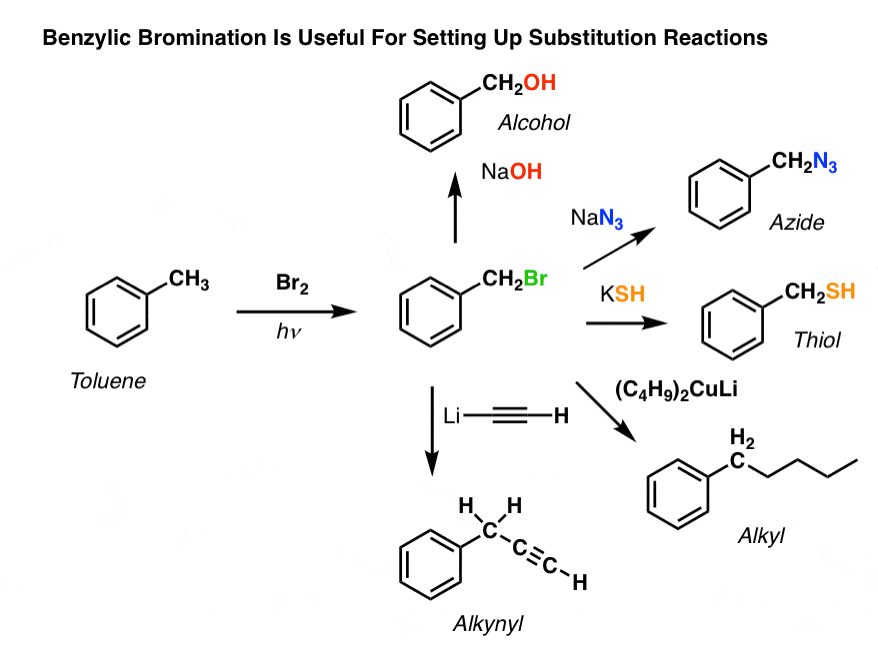
Siehst du, wie die Installation einer guten Abgangsgruppe an der Benzylposition uns alle möglichen Optionen für die Installation verschiedener funktioneller Gruppen gibt?
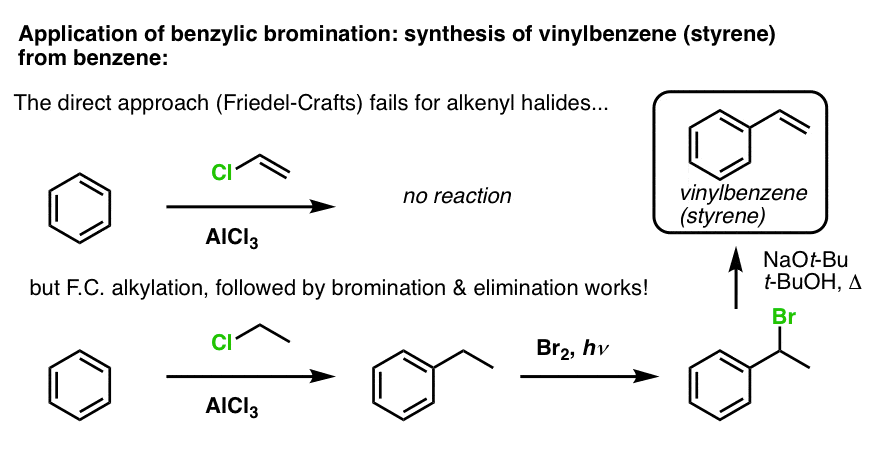
Ein anderes Beispiel ist die Synthese von Styrol aus Benzol. Auf den ersten Blick scheint der direkteste Ansatz die Friedel-Crafts-Reaktion von Vinylchlorid mit Benzol zu sein. Aber die Friedel-Crafts-Reaktion funktioniert nicht für Alkenylhalogenide (auch Vinylhalogenide genannt)! (Vinylcarbokationen sind weniger stabil als Alkylcarbokationen).
Wir können dieses Hindernis umgehen, indem wir eine Friedel-Crafts-Alkylierung mit Ethylchlorid durchführen, gefolgt von einer benzylischen Bromierung und dann einer Eliminierung (über E2, mit etwas wie NaOtBu/t-BuOH), um das Alken zu erhalten:
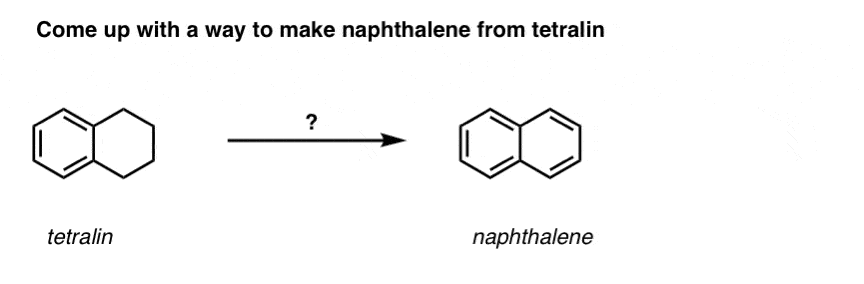
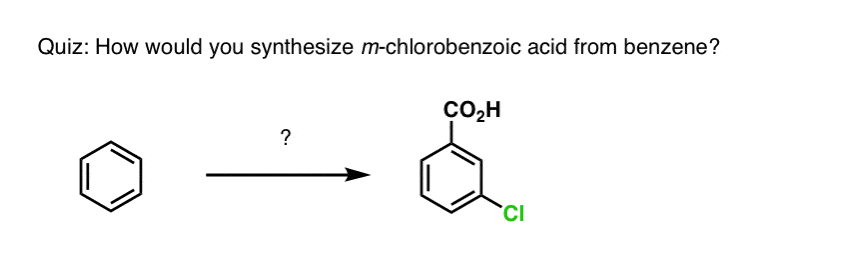
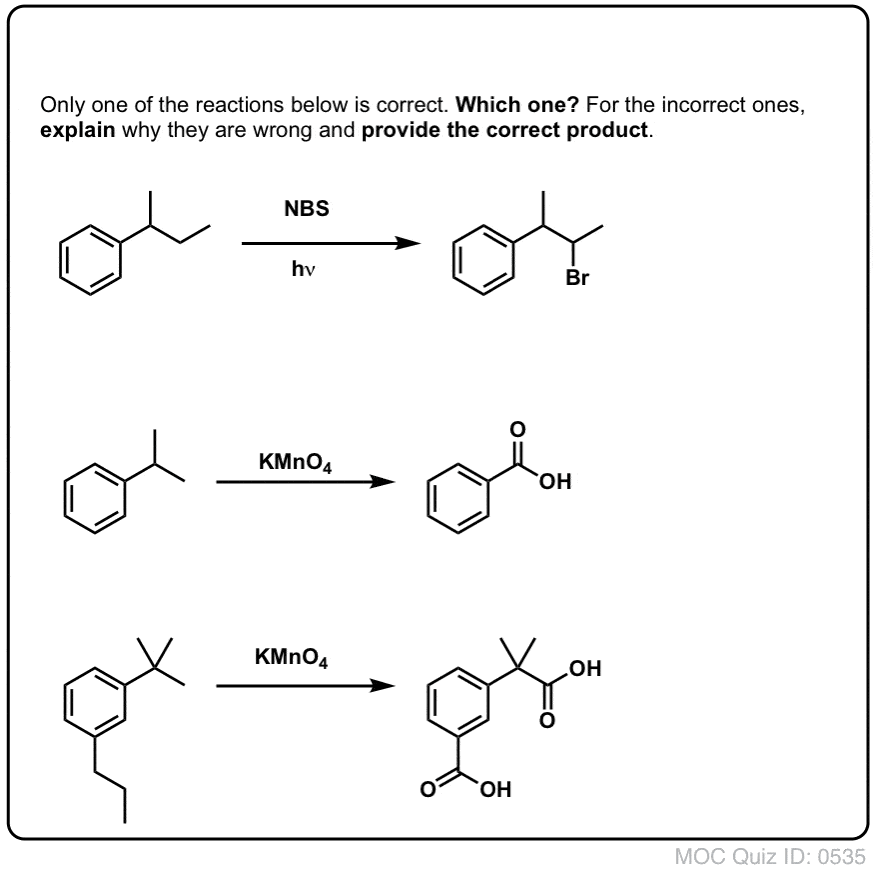
Ausgehend von dem oben Gesagten, hier ein kurzes Quiz für Sie. Wie könnten Sie Tetralin (unten links) in Naphthalin (unten rechts) umwandeln? Die Antwort steht in den Fußnoten.
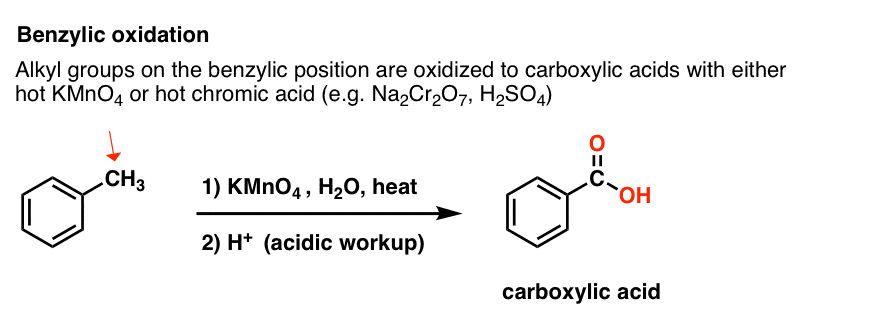
9. Benzylische Oxidation mit KMnO4 (oder H2CrO4)
Da die benzylische C-H-Bindung relativ schwach ist, kann man sich zu Recht fragen, ob an dieser Stelle auch andere Reaktionen (außer der Bromierung) durchgeführt werden können.
Das können sie! Ein Paradebeispiel ist die benzylische Oxidation, bei der eine benzylische C-H-Bindung gebrochen und eine benzylische C-O-Bindung gebildet wird.
Nun: Es gibt recht sanfte Reagenzien für die benzylische Oxidation, die das chemische Äquivalent zum Kitzeln der C-H-Bindung mit einer Feder sind, was zu einem benzylischen Aldehyd oder Keton führt.
Das ist nicht die Art von benzylischer Oxidation, die in einem typischen Einführungskurs in die organische Chemie behandelt wird!
Stattdessen ist das Hauptreagenz für benzylische Oxidation, das in den meisten Einführungslehrbüchern behandelt wird, heißes Kaliumpermanganat (KMnO4). Heiße Chromsäure (H2CrO4, die durch Kombination eines Dichromatsalzes wie Na2Cr2O7 mit einer starken Säure wie H2SO4 entsteht) kann ebenfalls für diese Zwecke verwendet werden.
KMnO4 ist nicht subtil. KMnO4 ist nicht sanft. KMnO4 ist nicht sanft.
Eine Lösung aus heißem KMnO4 ist wie ein Sack voller wütender Piranhas, die einem das ganze Fleisch vom Molekül reißen und nur die Knochen zurücklassen. (Wenn ich’s mir recht überlege, ist es so ähnlich wie mit deiner Leber!)
Heißes KMnO4 bricht jede benzylische C-H-Bindung und wandelt sie in eine C-O-Bindung um. Bei Toluol zum Beispiel ist das Produkt Benzoesäure (eine Carbonsäure).
Aber es bricht nicht nur die benzylischen C-H-Bindungen. Oh nein. Es greift auch C-C-Bindungen an, zumindest diejenigen, die nicht direkt an einen Phenylring gebunden sind. So wird z. B. para-Diethylbenzol in para-Benzoldicarbonsäure umgewandelt.
Beachte, dass die Alkyl-C-C-Bindung abgespalten werden muss, damit diese Oxidation stattfinden kann! (es wird wahrscheinlich bis zum CO2-Gas oxidiert).
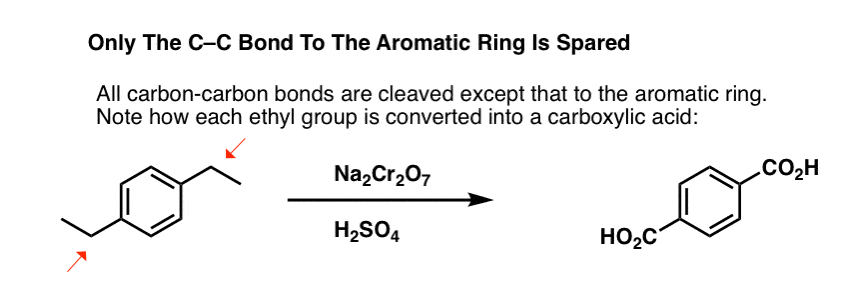
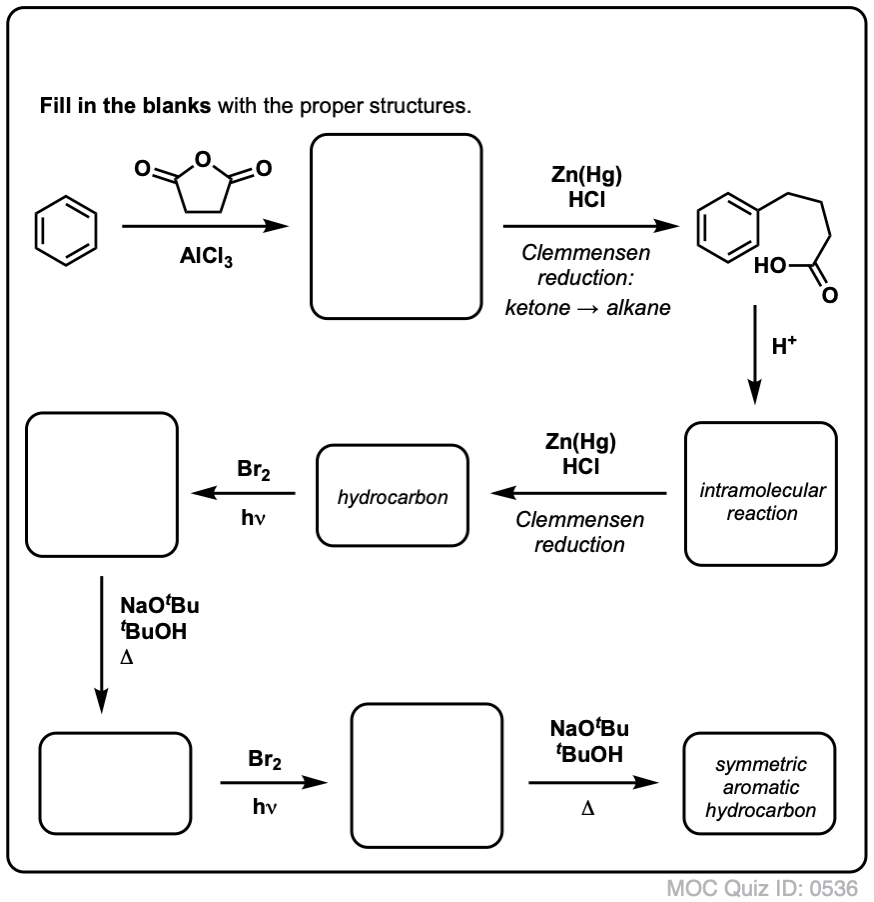
Eine interessante Variante ist ein zyklisches Molekül wie Tetralin; das Ergebnis ist die Dicarbonsäure.
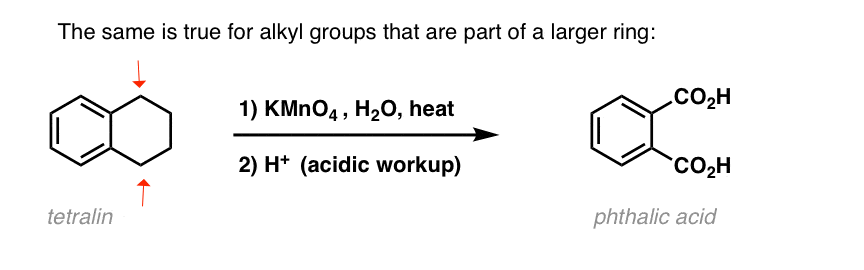
Diese Dicarbonsäure wird Phthalsäure genannt.
10. Benzylische Oxidation erfordert eine benzylische C-H-Bindung
Wie bei der benzylischen Bromierung findet keine Reaktion statt, wenn keine C-H-Bindung an der benzylischen Position vorhanden ist. Zum Beispiel scheitert die Reaktion vollständig mit t-Butylbenzol:
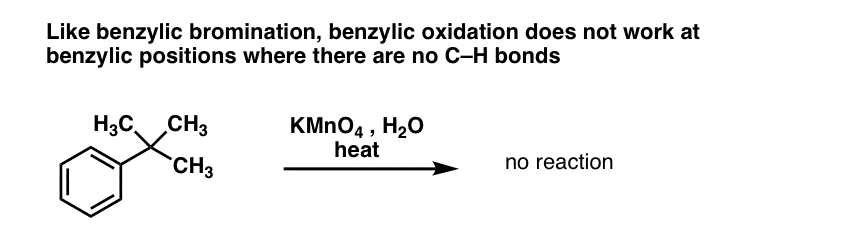
Der vollständige Mechanismus der Benzyloxidation ist zu komplex, langwierig und unsicher, um ihn hier darzustellen, aber der erste Schritt ist mit ziemlicher Sicherheit die homolytische Spaltung der C-H-Bindung durch das Mn=O zur Bildung des Benzylradikals.
Warum ist das wichtig?
Die benzylische Oxidation mit KMnO4 ist eine harte Reaktion, aber sie kann durchaus ihren Nutzen haben. Sie funktioniert am besten mit einfachen Molekülen, die keine empfindlichen funktionellen Gruppen haben und eine sehr raue Behandlung vertragen können.
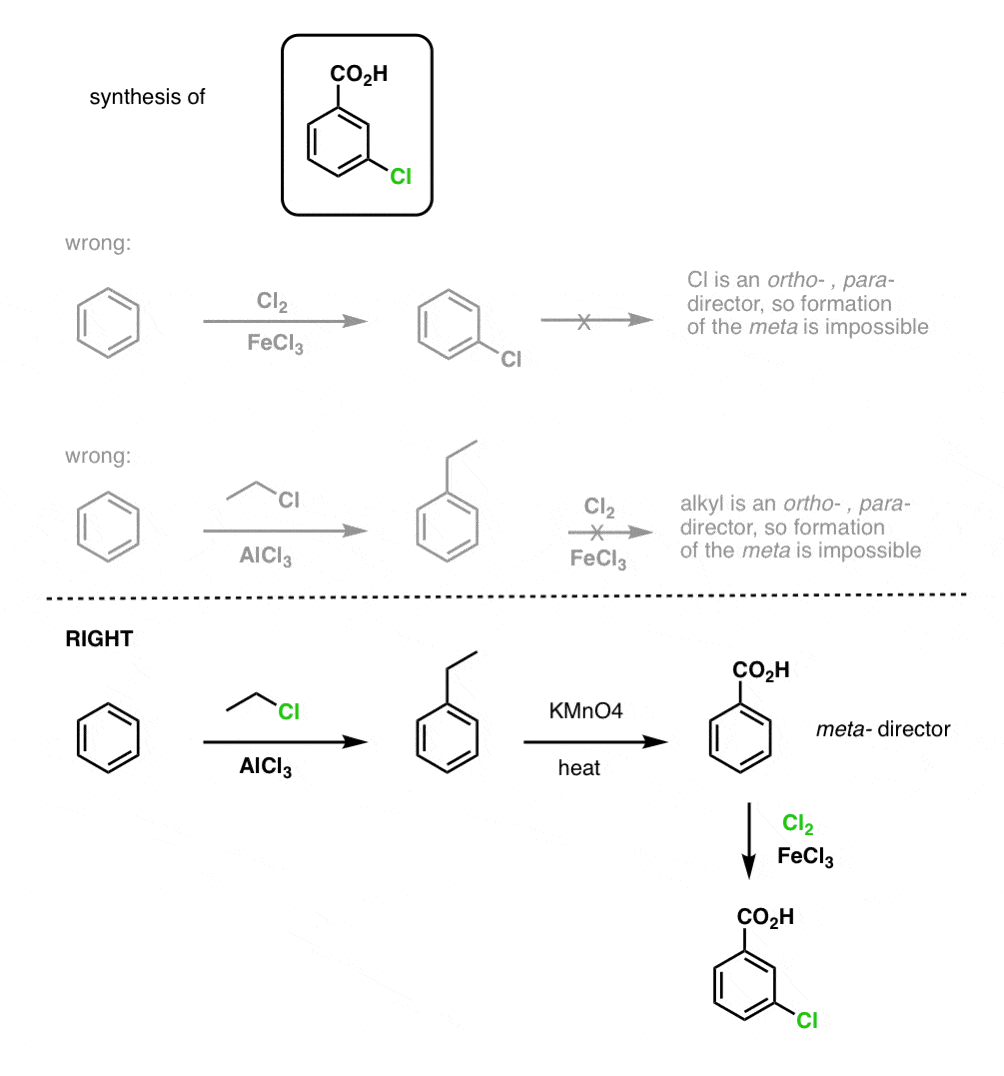
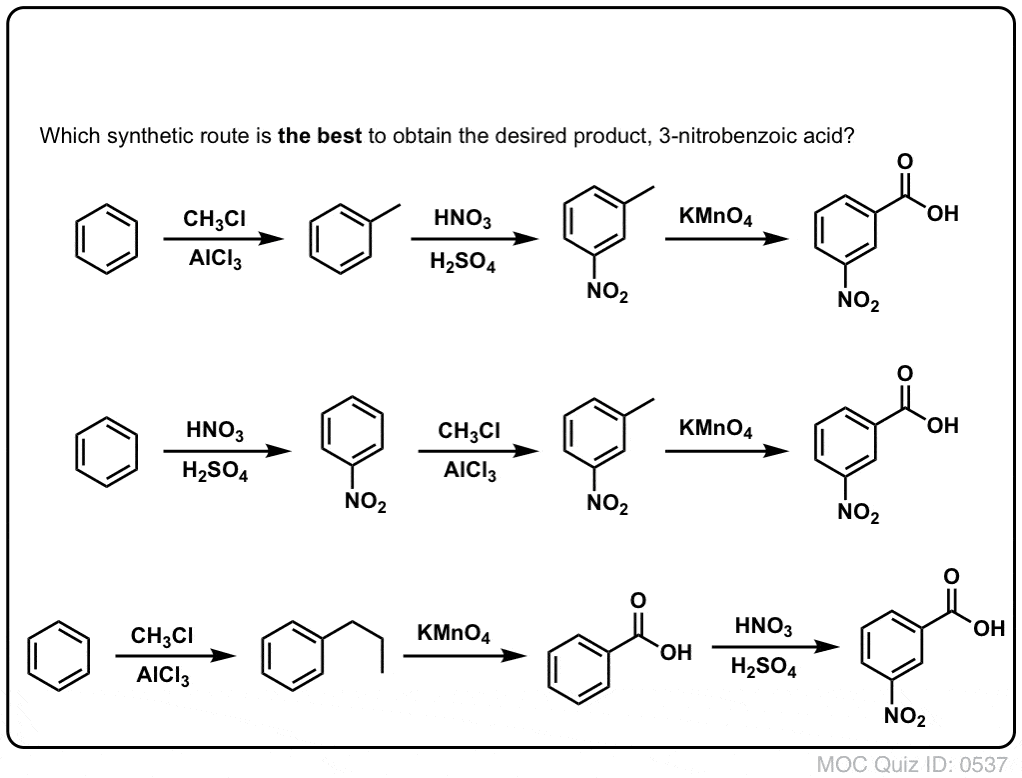
Zunächst ist zu beachten, dass Carbonsäuren nicht direkt über die Friedel-Crafts-Acylierung an einen Benzolring gebracht werden können, so dass die Alkylierung mit anschließender Oxidation eine nützliche Abhilfe ist.
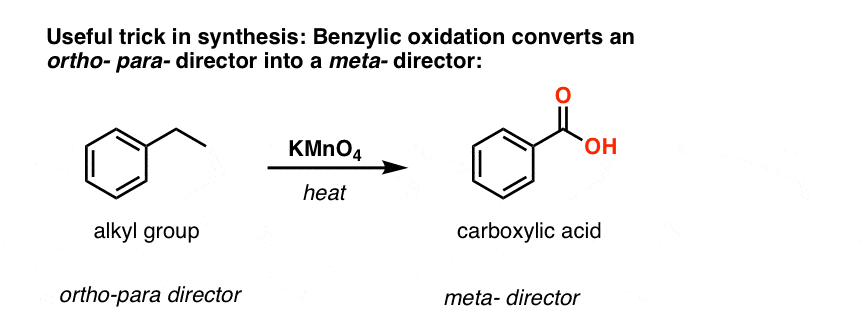
Die zweite nützliche Funktion in der Synthese ist die Tatsache, dass die benzylische Oxidation einen o- p-Direktor (eine Alkylgruppe) in einen Meta-Direktor umwandelt.
Wie gehen Sie zum Beispiel bei der Synthese des folgenden Moleküls vor? (Hinweis: Es handelt sich um eine benzylische Oxidation an irgendeiner Stelle).
Wir werden in ein paar weiteren Beiträgen noch viel mehr über die Synthese von aromatischen Verbindungen sagen.
Nächstes: Reduktion von benzylischen Carbonylen – die Clemmensen- und die Wolff-Kishner-Reduktion
Hinweise
„Kohl“ kann in der Chemie auch als Slangbegriff für „all das Zeug auf dem Molekül, das man aus irgendeinem Grund getrost ignorieren kann“ verwendet werden. Bryostatin zum Beispiel ist ein vielversprechendes Molekül, das als Krebsmittel eingesetzt werden kann. Das Problem ist, dass man eine Tonne eines seltenen Moostierchens braucht, um eine angemessene Menge Bryostatin zu erhalten, und das ist nicht genug für eine klinische Studie am Menschen. Deshalb haben mehrere Gruppen daran gearbeitet, einfachere, leichter zu synthetisierende „Bryologs“ herzustellen, bei denen der „Kohl“, der für die Antitumoraktivität nicht wesentlich ist, entfernt wurde.
Br2 reagiert im Allgemeinen nicht mit aromatischen Ringen ohne einen Lewis-Säure-Katalysator. Wenn jedoch eine starke Aktivierungsgruppe vorhanden ist (wie OH, NR2 usw.), kann es zu einer gewissen Bromierung des Rings kommen, insbesondere bei erhöhten Temperaturen.
Spaßfakt: „Benzylische Oxidation“ ist die Antwort auf das Rätsel, warum Methylbenzol (Toluol) nicht annähernd so stark krebserregend ist wie Benzol. Das liegt daran, dass Ihre Leber über Cytochrom p450-Enzyme verfügt (die Eisenarten im hohen Oxidationszustand enthalten), die die benzylische CH3-Gruppe zur wasserlöslicheren Carbonsäure oxidieren können, so dass sie über die Nieren ausgeschieden werden kann.
Dies erfordert zwei Oxidationen und zwei Ausscheidungen. Ein vorsichtiger Weg ist, einmal zu oxidieren (d.h. zu bromieren) und dann zu eliminieren, um ein Alken zu erhalten. Das Alken könnte dann erneut bromiert werden (unter Verwendung von NBS, um eine Bromierung der Doppelbindung zu vermeiden), um ein weiteres Bromierungsprodukt zu erhalten (hier ein benzylisches Bromierungsprodukt, aber auch ein allylisches), das mit einer Base behandelt werden könnte, um aromatisches Naphthalin zu erhalten.
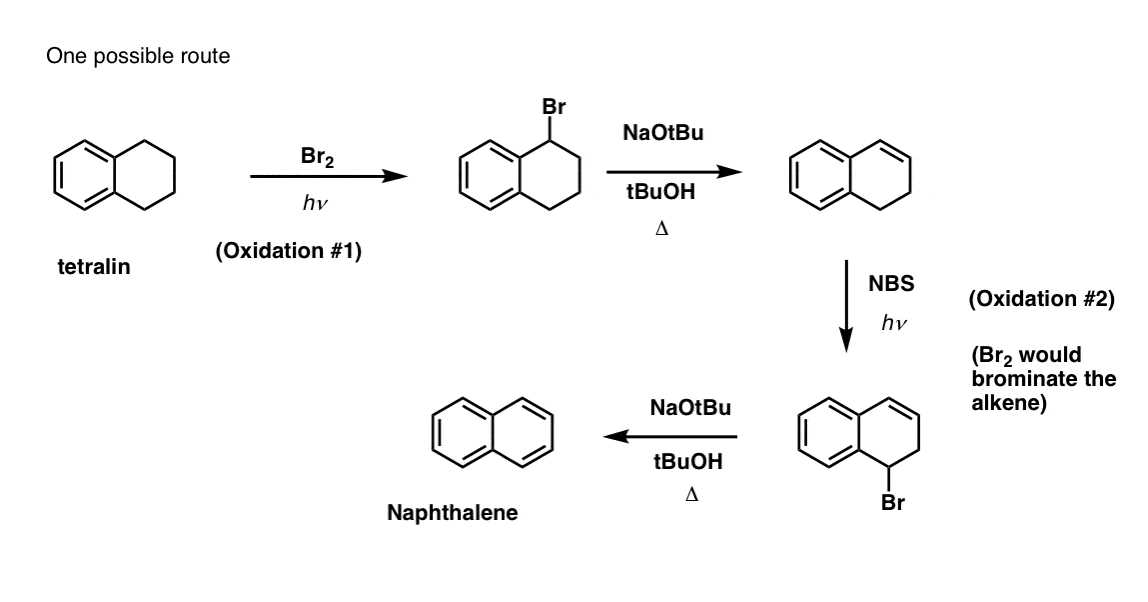
(in der Praxis zeigt sich, dass beide Bromierungen gleichzeitig mit Br2 bei hoher Temperatur durchgeführt werden können. Die Behandlung mit einer Base kann dann Naphthalin ergeben).
Antwort auf Quizfrage 2.
Quiz yourself!
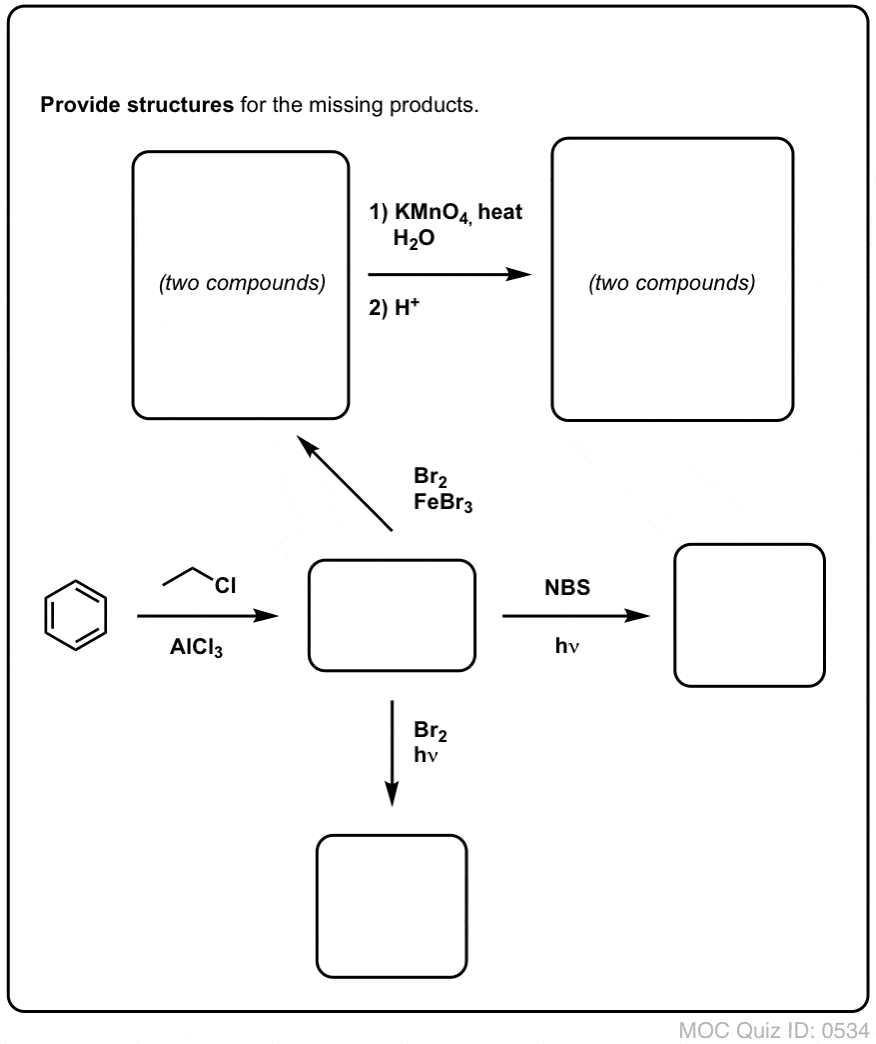 Klick zum Umdrehen
Klick zum Umdrehen 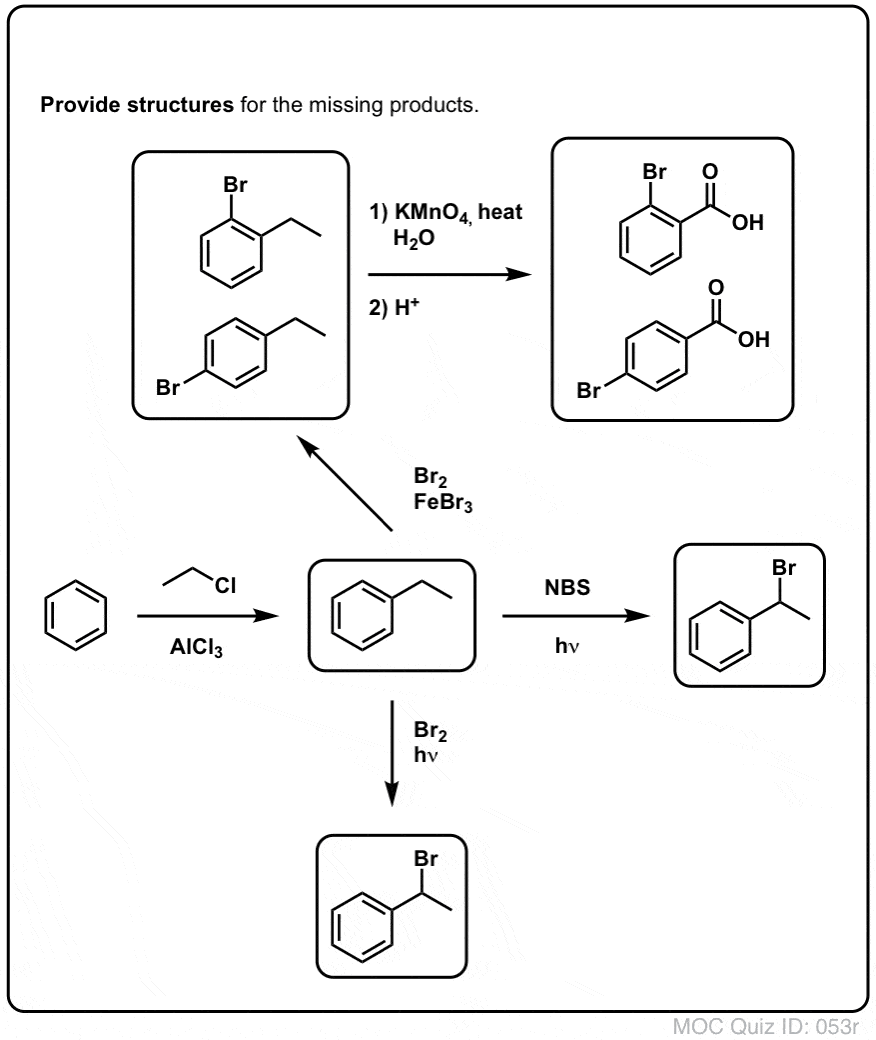
 Klick zum Umdrehen
Klick zum Umdrehen 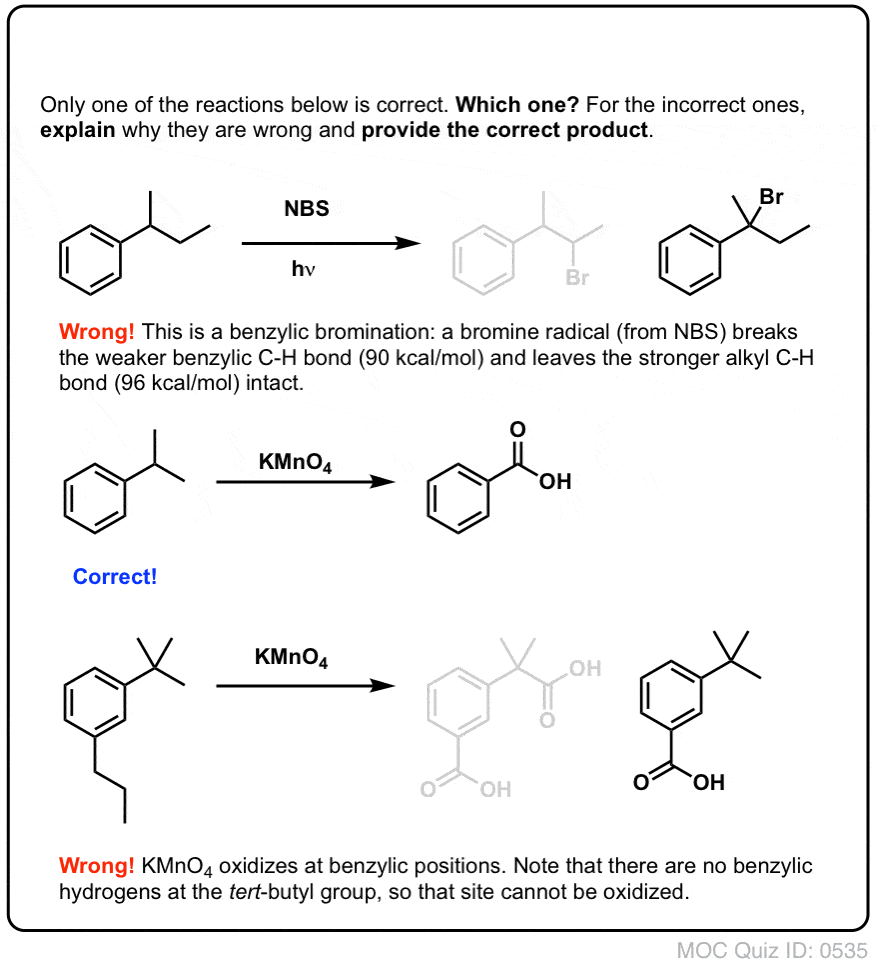
 Klicken Sie auf
Klicken Sie auf 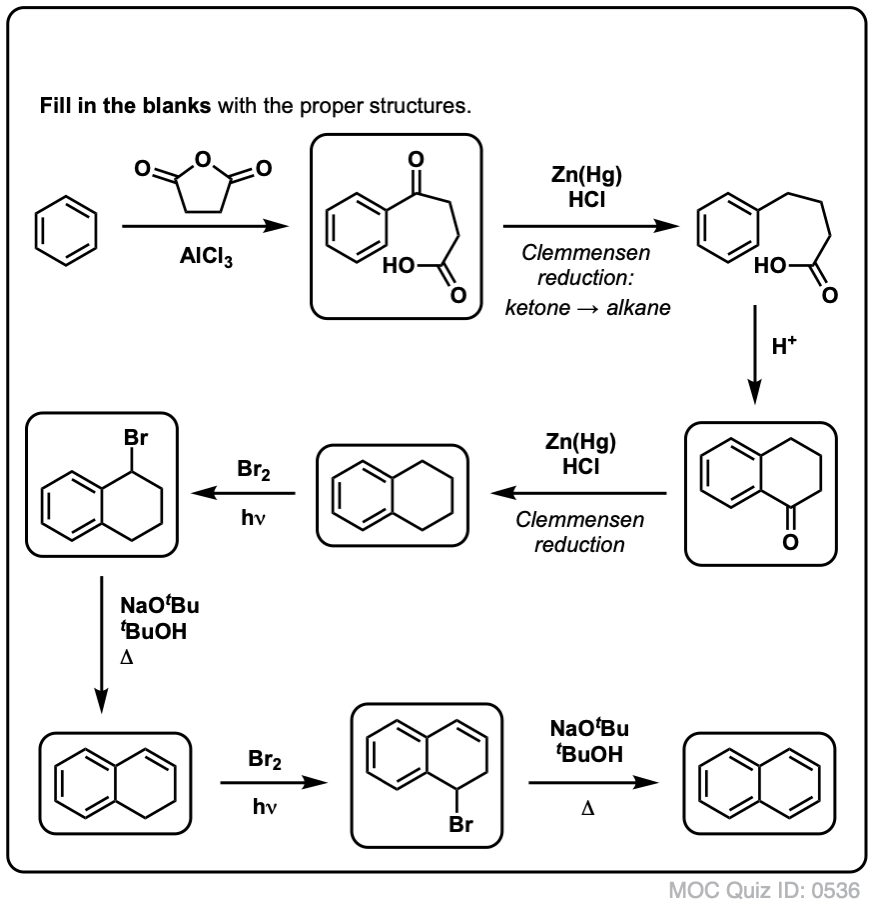
 Zum Blättern anklicken
Zum Blättern anklicken 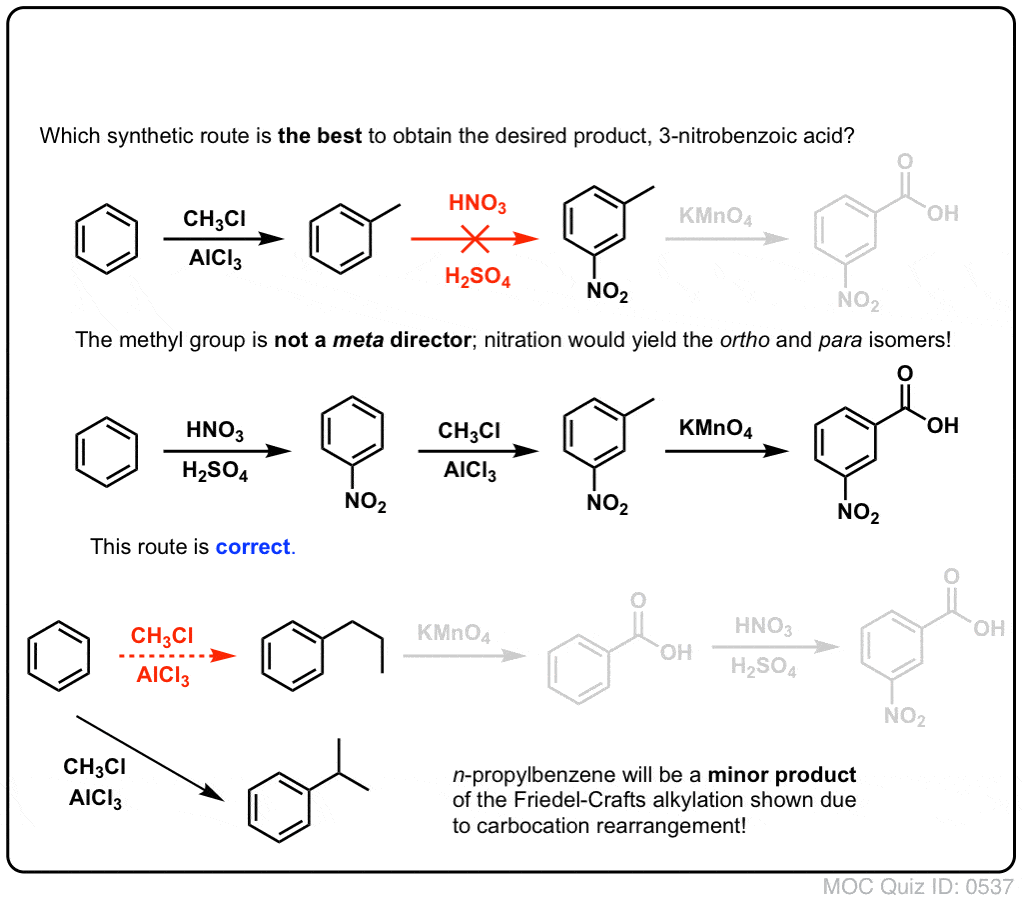
(Fortgeschrittene) Referenzen und weiterführende Literatur
Benzylische Bromierung:
Diese Reaktion wird auch als Wohl-Ziegler-Reaktion bezeichnet.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Die ersten beiden Veröffentlichungen zu dieser Reaktion. Wohl verwendete N-Bromacetamid als Bromierungsmittel, nicht NBS. Ziegler führte dann eine detaillierte Studie durch und berichtete, dass NBS als bequemes Bromierungsmittel für die allylische Bromierung verwendet werden kann. - Dibenzocycloocten: Multi-Gramm-Synthese eines zweizähnigen Liganden
Géraldine Franck, Marcel Brill, and Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Benzylbromierungen mit N-Bromsuccinimid in (Trifluormethyl)benzol
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Referenz #3 zeigt eine typische benzylische Bromierung unter Verwendung von NBS in CCl4, die aufgrund von Bedenken hinsichtlich der Toxizität weitgehend eingestellt wurde. Referenz #4 zeigt, dass PhCF3 als Lösungsmittel anstelle von CCl4 für die benzylische Bromierung verwendet werden kann. - Bromierungen mit N-Bromsuccinimid und verwandten Verbindungen. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Eine alte Übersichtsarbeit über diese Reaktion von dem bekannten Chemiker Carl Djerassi, dessen wichtigster Beitrag zur globalen Gesundheit die Entwicklung von Norethindron war – dem ersten weiblichen Verhütungsmittel. - N-Bromsuccinimid. III. Stereochemischer Verlauf der benzylischen Bromierung
H. J. Dauben Jr. und Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Eine mechanistische Studie über die Stereochemie der benzylischen Bromierung. Durch die Beobachtung der Bildung von racemischen Benzylbromiden aus prochiralen Substraten wird die Intermediarität von Radikalen in dieser Reaktion weiter gestärkt. - Mechanismen der Benzylbromierung
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Die benzylische Bromierung folgt demselben Mechanismus wie die allylische Bromierung, wie dieser Artikel erklärt.NBS (N-Bromsuccinimid) ist ein geeignetes Reagenz für die radikalische Bromierung, und die folgenden Arbeiten sind mechanistische Studien mit NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Diese Arbeiten von Prof. J. C. Martin (UIUC) entstanden zu Beginn seiner Karriere, bevor er die Arbeiten durchführte, für die er am meisten bekannt ist (Studien über „hypervalente“ Moleküle, einschließlich der Entwicklung des „Dess-Martin-Periodinans“). - Die Identität der kettentragenden Spezies bei Bromierungen mit N-Bromsuccinimid: Selektivität von substituierten N-Bromsuccinimiden gegenüber substituierten Toluolen
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-Bromsuccinimid. Mechanisms of allylic bromination and related reactions
J. H. Incremona and James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidyl radical as a chain carrier. Mechanismus der Allylbromierung
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radical Bromination of Cyclohexene in CCl4 by Bromine: Addition versus Substitution
D. W. McMillen und John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Dieser Aufsatz beschreibt sorgfältige kinetische Studien, die zeigen, dass eine niedrige Br2-Konzentration (wie sie von unreiner NBS bereitgestellt wird) eine radikalische Substitution gegenüber einer polaren Additionsreaktion begünstigt. - o-XYLYLEN DIBROMID
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Ein zuverlässiges Verfahren zur benzylischen Bromierung mit Br2 in Organic Syntheses. - Bromierung von Tetralin. Short and Efficient Synthesis of 1,4-Dibromonaphthalene
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek and Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Eine bequeme Synthese von 1,4-Dibromnaphthalin aus Tetralin über benzylische Bromierung.Benzylische Oxidation:
Es gibt viele Strategien für die benzylische Oxidation, einschließlich der Verwendung von konzentrierten Lösungen von KMnO4 oder Chromsäure. - Kinetische Untersuchungen der Oxidation von aromatischen Verbindungen durch Kaliumpermanganat. Teil IV. n- und iso-Propylbenzol
C. F. Cullis und J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDIN-DERIVATEN X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook and S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Wenn ein weiterer Substituent an der benzylischen Position vorhanden ist, führt die Oxidation zu einem Keton anstelle einer Carbonsäure. - Heterogene Permanganat-Oxidationen. 7. The Oxidation of Aliphatic Side Chains
Nazih A. Noureldin, Dongyuan Zhao, and Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenzien können an feste Träger adsorbiert werden, um die Durchführung von Reaktionen zu erleichtern und den Abfall zu reduzieren. In diesem Fall ändert sich die Reaktivität leicht, indem das KMnO4-Reagenz heterogen gemacht wird, und dies kann für einige chemoselektive Oxidationen ausgenutzt werden. - Selektive Oxidation an Kohlenstoff in der Nähe von aromatischen Systemen mit IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Eine frühe Arbeit von (jetzt Rockstar der Totalsynthese) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA), als er noch Doktorand in Prof. Nicolaous Gruppe war. Dabei wird IBX (ein hypervalentes I(V)-Reagenz) für Benzyloxidationen verwendet, die über einen radikalischen Mechanismus ablaufen. Es handelt sich um eine nützliche Reaktion mit einem breiten Substratspektrum, wie 25 Beispiele in der Arbeit zeigen. - Direkte und selektive benzylische Oxidation von Alkylarenen über C-H-Abstraktion unter Verwendung von Alkalimetallbromiden
Katsuhiko Moriyama, Misato Takemura, und Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Dabei wird Oxon als terminales Oxidationsmittel für die Benzyloxidation verwendet. - Synthese von Benzylalkoholen durch C-H-Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Dabei wird Mesylperoxid als Oxidationsmittel für die selektive Oxidation von benzylischen Positionen zu Alkoholen verwendet. Es entsteht das Benzylmesylat, das zum Alkohol hydrolysiert werden kann. - Elektrochemische Benzyloxidation von C-H-Bindungen
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz und Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Benzyloxidation kann auch durch Elektrochemie erfolgen. - Allyl- und Benzyloxidationsreaktionen mit Natriumchlorit
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 ist preiswert und kann auch als Oxidationsmittel verwendet werden.
Schreibe einen Kommentar