Frontiers in Neuroanatomy
On Januar 6, 2022 by adminIntroduction
Die Magnetresonanz-Diffusionstensortraktographie (DTT) wird häufig für die Verfolgung von Nervenfasern und die Analyse spezifischer Faserbahnen eingesetzt. Ein wichtiger Teil der DTT-Anwendung in vivo ist die Festlegung der Region of Interest (ROI) für den DTT-Analyseprozess. Viele Forscher haben ROIs auf der Grundlage des anatomischen Bildes und der berechneten farbkodierten fraktionierten Anisotropiekarte (FA) entsprechend ihrem Forschungszweck festgelegt (Hong et al., 2009; Kim und Jang, 2013; Li et al., 2013). Obwohl für diese Ansätze eine auf mehreren ROIs basierende Analyse verwendet wird, haben sie aufgrund der benutzerabhängigen ROI-Einstellungen einen Nachteil in Bezug auf die Genauigkeit der Ergebnisse. Um diesen Nachteil zu überwinden, wurden die Ergebnisse der funktionellen MRT-Aktivierung (fMRI) mit der DTT-Analyse kombiniert (Propper et al., 2010; Li et al., 2013). Dieser Kombinationsansatz ermöglicht eine genauere ROI-Einstellung als eine manuelle ROI-Einstellung. Allerdings könnten die Größen der fMRI-Aktivierungsbereiche je nach dem gegebenen statistisch signifikanten Wert und dem zusätzlichen Bildaufnahmeprozess geändert werden, was Zeit kostet.
In dieser Studie haben wir die Brodmann’sche Fläche (BA) als Vorlage verwendet, um ROIs für eine genaue DTT-Analyse für den Faszikulus arcuatus (AF) zu setzen. Unter den zahlreichen neuralen Faserbahnen im menschlichen Gehirn ist der AF eine wichtige neurale Faserbahn, die die frontalen (Broca-Areal) und temporalen (Wernicke-Areal) Areale verbindet und mit Sprachfunktionen in Verbindung gebracht wird. So verursachten Läsionen der AF verschiedene Arten von Sprachproblemen wie Leitungsaphasie und Sprachdefizite (Yamada et al., 2007; Jang, 2013; Li et al., 2013). Daher ist die Identifizierung der anatomischen Merkmale und der Lage der NF-Faserbahnen im normalen menschlichen Gehirn oder bei Patienten mit Aphasie ein wichtiges Thema, da sie Neurowissenschaftlern oder klinischen Forschern bei der Vorhersage des Erholungszustands der Nervenfasern bei Aphasie und bei Folgestudien helfen würde. Darüber hinaus ist die BA-Schablone eine Art Standardschablone, die Regionen des menschlichen Kortex zeigt, die auf der Grundlage zytoarchitektonischer Merkmale in 46 Bereiche unterteilt sind (Thottakara et al., 2006). Durch die Anwendung der Eigenschaften der BA-Schablone für unterteilte Kortexregionen als Standard, bietet unser analytischer Ansatz eine genaue und hilfreiche ROI-Einstellung für DTT-Studien. Darüber hinaus erstellten wir eine Karte der Wahrscheinlichkeit der Faserbahnen von AF, um die Faserbahnen im Gehirn abzuschätzen.
Materialien und Methoden
Probanden
Dreizehn gesunde Probanden, neun Männer und vier Frauen, nahmen an dieser Studie teil (Rechtshänder, Durchschnittsalter: 38,7 ± 6,4 Jahre, Altersbereich: 26-50 Jahre). Sie hatten keine neurologischen oder körperlichen Erkrankungen in der Vorgeschichte. Alle Teilnehmer wurden von einem Radiologen und einem Neurologen untersucht und als unauffällige Personen diagnostiziert. Alle Probanden verstanden den Zweck der Studie und gaben eine schriftliche Einverständniserklärung ab. Dieses Studienprotokoll wurde vom örtlichen Institutional Review Board genehmigt.
Datenerfassung und -analyse
Diffusions-Tensor-Imaging (DTI)-Daten wurden mit einem 1,5-T-MR-Scanner (Gyroscan Intera, Philips Healthcare, The Best, Niederlande) mit einer Sechs-Kanal-Phased-Array-Sensitivitätskodierung (SENSE)-Kopfspule und einer Single-Shot-Spin-Echo-Echo-Planar-Imaging (EPI)-Pulssequenz erfasst. Die DTI-Daten wurden mit folgenden Parametern erfasst: Wiederholungszeit (TR)/Echolaufzeit (TE) = 10.726/75 ms, Sichtfeld (FOV) = 221 mm, Erfassungsmatrix = 96 × 96, Rekonstruktionsmatrix = 128 × 128, Schichtdicke = 2,3 mm und SENSE-Faktor = 2. Die Diffusionsgewichtung wurde entlang von 32 nicht-kollinearen und nicht-koplanaren diffusionssensibilisierenden Gradienten mit einem b-Wert von 1000 s/mm2 vorgenommen. Es wurden 67 zusammenhängende transversale Schichten aufgenommen, die das gesamte Gehirn ohne Schichtlücken abdeckten, und es wurde eine verschachtelte Schichtaufnahme durchgeführt, um das Übersprechen zu minimieren, das durch die fehlende Lücke zwischen den Schichten verursacht wurde.
Vor der DTI-Datenanalyse wurden die Auswirkungen von Wirbelströmen und Kopfbewegungen korrigiert, indem alle DWI-Bilder mit Hilfe der affinen Multiskalenregistrierung von FSL (Smith et al., 2004)1 auf nicht-diffusionsgewichtete Bilder (b-Wert = 0 s/mm2) registriert wurden. Für die Berechnung der Diffusionsparameterkarten und die Fasernachverfolgung wurde die Software DTI Studio (Department of Radiology, Johns Hopkins University School of Medicine, Baltimore, MD, USA) verwendet, die eine Faserzuordnung durch den kontinuierlichen Tracking-Algorithmus (FACT) und einen Ansatz mit mehreren ROIs ermöglichte (Wakana et al., 2004; Jiang et al., 2006). Zur Extraktion und Auswertung der AF-Faserbahnen jedes Probanden wurden zwei Standard-Gehirnschablonen verwendet, die in der MRIcro-Software2 enthalten sind. Die BA-Vorlage bietet eine Volumenmaske, die in 46 diskrete kortikale Regionen unterteilt ist, die jeweils ein anderes BA-Gebiet repräsentieren. Während wir die vordefinierten kortikalen Regionen in der BA-Vorlage verwenden, können wir für die ROI-Auswahl beim Fasertracking einfach die spezifische Region auswählen oder einzeichnen, die mit dem Ursprung der neuronalen Faserbahnen korreliert ist. Auf diese Weise ist es möglich, den durch die benutzerabhängige ROI-Einstellung verursachten Fehlerfaktor zu minimieren. Darüber hinaus wurde die MNI T1w-Vorlage für die Normalisierung der Gehirnbilder verwendet. Alle DTI-Datensätze, die von MRT-Scannern für jeden Probanden erfasst wurden, und die berechnete FA-Karte haben leicht unterschiedliche Orientierungs- und Ortsinformationen. Daher können einige fehlerhafte Faktoren, die durch unterschiedliche Strukturen und/oder Orte zwischen den Probanden hervorgerufen wurden, durch den Normalisierungsprozess des Gehirns vermieden werden. Darüber hinaus ist der Normalisierungsprozess, der auf dem Vorlagenbild für alle Datensätze basiert, hilfreicher für die Erstellung der Wahrscheinlichkeitsbahnkarte der Faserbahnen, um die Konsistenz der Orte zu erhalten. In dieser Studie wurden die AF-Faserbahnen nur in der dominanten (linken) Hemisphäre aller Probanden analysiert. Das Flussdiagramm der Verarbeitungsverfahren ist in Abbildung 1A dargestellt und wurde in der folgenden Reihenfolge durchgeführt: (i) Die FA-Karte des Probanden wurde mit der Software DTI Studio berechnet; (ii) die T1w-Vorlage wurde mit der FA-Karte jedes Probanden mit der Software SPM8 (Wellcome Department of Cognitive Neurology, London, UK) koregistriert. Aufgrund des geringen Unterschieds im Bildkontrast zwischen der FA-Karte und der T1w-Schablone ist es möglich, den fehlerhaften Faktor im Ko-Registrierungsprozess zu minimieren; (iii) Um den Normalisierungsprozess zwischen der BA-Schablone und den Diffusionstensor-Datensätzen durchzuführen, wurde die Transformationsmatrix, die in Schritt (ii) erzeugt wurde, auf die BA-Schablone angewendet; (iv) Zwei ROIs wurden im Broca-Areal und im Wernicke-Areal auf der Grundlage der normalisierten BA-Schablone gezeichnet, und der AF-Fasertrakt jedes Probanden wurde anhand der folgenden Kriterien extrahiert: ein Voxel mit einem FA-Wert unter 0.2 oder einem Trajektorienwinkel von weniger als 80 Grad; und (v) binäre Masken der extrahierten Faserbahnen für jeden Probanden wurden erstellt. Die binären Masken haben nur zwei Werte: Eins (Voxel für die Lage der Faserbahnen) und Null (Voxel für die Lage der Nicht-Faserbahnen). Die Masken aller Probanden wurden anhand der MNI T1w-Vorlage von MRIcro mit einer affinen Registrierung mit 12 Parametern unter Verwendung der inversen Transformationsmatrix des ursprünglichen Koregistrierungsprozesses normalisiert. Diese normalisierten Faserbahnmasken wurden summiert und durch die Gesamtzahl der Probanden geteilt, um die probabilistische Karte der AF zu erstellen. Die probabilistische Pfadkarte wurde über die MNI-T1w-Schablone gelegt, wobei je nach Wahrscheinlichkeitswert eines Voxels ein anderer Maßstab verwendet wurde.
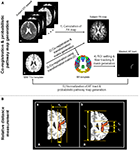
Abbildung 1. Flussdiagramm der Datenanalyseverfahren für die ROI-Einstellung bei der Faserverfolgung/probabilistischen Pfadgenerierung (A) und den Messprozess der relativen Faserpositionen (B). Für die Messung der relativen Lage des Fasciculus arcuatus (AF) in der probabilistischen Bahnkarte zeigt (a) die Methode der Messung des mediolateralen Lageverhältnisses zwischen Xa und Xb und (b) die Methode der Messung des anteroposterioren Anteilsverhältnisses zwischen Ya und Yb oder Yc an. Die Messverfahren der Lageverhältnisse wurden in der T1w-Schablone des Montreal Neurological Institute (MNI) durchgeführt, die auf der Corona radiata-Lage dargestellt ist.
Um die Lage der AF-Faserbahnen bei jedem Probanden zu untersuchen, wurde die relative Lage durch das Belegungsverhältnis der AF-Bahn auf der Basis der linken Hemisphäre gemessen. Die Messungen wurden mit dem mediolateralen Teil und dem anteroposterioren Teil unter Verwendung des generierten probabilistischen Pfades der AF-Faserbahnen auf der MNI T1w-Schablone durchgeführt (Abbildung 1B). Die mediolaterale Lage wurde anhand des Verhältnisses zwischen der Länge von der Längsfissur zur äußersten lateralen Grenze der linken Gehirnhälfte (Xa) und der Länge von der medialen zur lateralen Lage des horizontalen Teils der AF (Xb) wie folgt gemessen: (Xa/Xb) × 100. Das anteroposteriore Lageverhältnis wurde zwischen der Länge von der vordersten bis zur hintersten Begrenzung (Ya) und der Länge von der vorderen bis zur hinteren Begrenzung des vertikalen Teils der NF (Yb oder Yc) gemessen. Das Verhältnis der anteroposterioren Lage wurde separat auf der Grundlage des Zusammenflusses des horizontalen Teils (Verhältnis zwischen Ya und Yb) und des vertikalen Teils (Verhältnis zwischen Ya und Yc) wie folgt gemessen: (Ya/Yb) × 100 und (Ya/Yc) × 100.
Ergebnisse
Die probabilistischen Pfadkarten der AF-Faserbahnen für alle Probandengruppen sind in Abbildung 2 dargestellt. Die Farbskala gibt die Wahrscheinlichkeit an, mit der ein Voxel Teil der AF-Faserbahn ist. In dieser probabilistischen Karte der Vorhofflimmern-Faserbahnen betrug das gemessene mediolaterale Positionsverhältnis 18 %. Das gemessene Verhältnis der anteroposterioren Position lag bei 35 %, basierend auf dem AF-Krümmungspunkt. Das Verhältnis wurde für den oberen Teil mit 15 % und für den unteren Teil mit 20 % gemessen. Aus den Ergebnissen geht hervor, dass der gemessene mediolaterale Anteil der AF 1/5 der gesamten mediolateralen Länge der Hemisphäre auf der MNI T1w-Schablone ausmacht. Der gemessene anteroposteriore Anteil der AF betrug 1/2 Länge im Vergleich zur gesamten anteroposterioren Länge der Hemisphäre. Darüber hinaus wurde der extrahierte NF-Fasertrakt, der der transversalen Bildebene der MNI T1w-Schablone überlagert wurde, aufgrund der charakteristischen, gekrümmten Form des NF-Fasertrakts in vivo nicht vollständig dargestellt; Die extrahierten AF-Faserbahnen für jeden Probanden, die durch das Maskenbild in der Analyseprozedur erstellt wurden (Abbildung 1), und die rekonstruierte Wahrscheinlichkeitskarte (Abbildung 2) beschreiben jedoch, dass die AF-Faserbahnen aus unseren Ergebnissen zwei Hirnregionen zwischen dem Broca-Areal im inferioren frontalen Gyrus und dem Wernicke-Areal im posterioren superioren temporalen Gyrus verbinden. Darüber hinaus zeigte die erstellte probabilistische Pfadkarte deutlich, dass die Verteilungen der kombinierten AF-Faserbahnen, die durch die BA-Schablone für die ROI-Einstellung von jedem Probanden extrahiert wurden, im menschlichen Gehirn gut lokalisiert und definiert waren, ohne dass es zu Versetzungsfehlern kam.
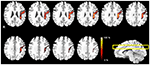
Abbildung 2. Die probabilistischen Pfadkarten der AF-Faserbahnen in den Multi-Slice-Lokalisationen. Die Farbskala zeigt die probabilistischen Werte der Faserbahnen an.
Diskussion
Die BA ist eine gut definierte menschliche Hirnrindenregion mit 46 Arealen, die sich durch ihre einzigartigen Funktionen auszeichnen. Viele Forscher haben die BA-Schablone verwendet, um bestimmte Orte der Hirnaktivität in ihren Studien anzuzeigen, z. B. bei Patienten mit neurologischen Erkrankungen oder Behandlungsstrategien, weil die BA Regionen nicht nur anatomisch, sondern auch funktionell unterscheiden. Zu den BA gehören insbesondere das Broca-Areal und das Wernicke-Areal, die über den neuralen Fasertrakt AF verbunden sind, der um die Sylviaspalte herumführt und die temporalen und frontalen Sprachareale verbindet (Rilling et al., 2008; Jang, 2013; Tak und Jang, 2014). Man kann davon ausgehen, dass der AF der wichtigste Fasertrakt ist, der mit Sprachfunktionen assoziiert ist, und er hat eine ausgeprägte Kurvenform, die im Gegensatz zu anderen Fasertrakten wie dem kortikospinalen Trakt (repräsentative superior-inferiore Faserrichtung) oder dem Corpus callosum (repräsentative links-rechts Faserrichtung) verschiedene Richtungen kombiniert. Da der AF-Fasertrakt in hohem Maße mit Patienten assoziiert ist, die an Sprachstörungen wie Aphasie leiden, ist die Identifizierung der genauen Lage des AF-Fasertrakts aus klinischer Sicht von großer Bedeutung. Viele Ansätze mit multimodalen Bildgebungsverfahren und/oder invasiven intraoperativen Eingriffen wurden durchgeführt, um die neuroanatomischen Merkmale der AF-Faserbahnen zu ermitteln und die entscheidende Rolle für die Feed-Forward- und Feedback-Kontrolle der Sprachproduktion zu bewerten (Duffau et al., 2002; Breier et al., 2008; Hosomi et al., 2009; Marchina et al., 2011; Zhao et al., 2012; Yamao et al., 2014). Die DTT-Methode, die in der Vergangenheit zur Verfolgung der Nervenfaserbahnen eingeführt wurde, wird häufig verwendet, um die Eigenschaften der Nervenfasern anhand der berechneten Diffusionsphänomene der Wassermoleküle in vivo zu demonstrieren. Dieser Ansatz ist für die Visualisierung der Fasertrakte geeignet und leicht anzuwenden. Aufgrund dieser Eigenschaften ermöglichten die DTT-Methode und ihre technische Entwicklung die Visualisierung der mit der weißen Substanz verbundenen Faserbahnen in vivo. Doch obwohl die Auswertung der Faserbahnen mit der DTT-Methode vorangetrieben wurde, gibt es immer noch eine Einschränkung aufgrund der Genauigkeit der ROI-Einstellung in der DTT.
In dieser Studie haben wir die nicht benutzerabhängige ROI-Einstellung für die DTT auf der Grundlage der BA-Vorlage verwendet. Die von der BA-Vorlage definierten ROIs haben im Vergleich zu benutzerabhängigen ROI-Einstellungen einen Vorteil für die Konsistenz der Nervenfaserbahnen. Darüber hinaus normalisierten wir einzelne AF-Bahnen auf die MNI T1w-Schablone, um die Tendenz der AF-Lokalisierung und ihren probabilistischen Pfad im menschlichen Gehirn zu untersuchen. Der probabilistische Pfad könnte eine bessere Schätzung der Verbindungswahrscheinlichkeit der Faserbahnen für eine Gruppe von Probanden liefern. Bislang wurden die ROI-Auswahlverfahren für die DTT-Analyse im Allgemeinen mit benutzerabhängigen ROI-Einstellungen durchgeführt, was zu Analysefehlern in Teilen der Identität und Reproduzierbarkeit führen kann, auch wenn die ROI von erfahrenen Forschern gut definiert wurde. Der vorgeschlagene Analyseansatz für die Verfolgung menschlicher Nervenfasern in vivo, der mit der ROI-Auswahl auf der Grundlage der BA-Vorlage durchgeführt wird, hat eine analytische Stärke, die die Erfassung genauerer Faserbahnen unabhängig von einer Kontamination durch ROI-Einstellungsfehler durch Benutzer oder Forscher ermöglicht. Im Hinblick auf die Aufrechterhaltung der Identifizierung und Reproduzierbarkeit der Ergebnisse, kann es die hohe Vereinbarungen aufgrund der beiden wichtigsten analytischen Verfahren wie Gehirn Normalisierung und ROI Bereich Extraktion von BA-Vorlage ohne manuelle Einstellungen zur Verfügung gestellt werden. Darüber hinaus könnten unsere Ansätze leicht an die Analyse für DTT-Studien angepasst werden und zu einer genauen Analyse der Faserverbindungen von BA in anderen Hirnbereichen führen.
Es gibt einige Einschränkungen dieser Studie. Erstens ist unser DTT-Analyseverfahren durch die Berücksichtigung des deterministischen Fasertracking-Algorithmus eingeschränkt. Daher glauben wir, dass die Anwendung anderer Faserverfolgungsalgorithmen, die auf dem probabilistischen Faserverfolgungsalgorithmus mit BA-Template und Vergleichsstudien basieren, hilfreichere Informationen zur Bewertung der BA-Template-basierten ROI-Einstellung in der klinischen Forschung liefern werden. Zweitens haben wir bei der Rekrutierung der Probanden nur normale Probanden mit einer relativ kleinen Population berücksichtigt. In einer zukünftigen Studie, an der eine große Anzahl von Probanden und/oder Patienten mit Erkrankungen im Bereich der AF-Fasern teilnehmen, werden die Ergebnisse unserer Meinung nach zuverlässiger sein.
Zusammenfassend lässt sich sagen, dass wir das AF-Fasertracking mit dem BA-Template für die ROI-Auswahl und seinen probabilistischen Pfad im menschlichen Gehirn demonstriert haben. Wir glauben, dass die von uns vorgeschlagenen analytischen Ansätze ausreichend auf andere DTT-Studien zur ROI-Einstellung ausgedehnt werden können, und dass diese genaue Informationen über neuronale Faserbahnen und klinische Forschungseinstellungen liefern können.
Beiträge der Autoren
D-HL, D-WL und B-SH haben die Studie entworfen und koordiniert. D-HL und B-SH erfassten die Daten. D-HL und D-WL analysierten die Daten. D-HL verfasste das Manuskript. B-SH betreute die Studie.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Abkürzungen
BA, Brodmann-Areal; ROI, Region von Interesse; AF, Arcuate Fasciculus; DTT, Diffusions-Tensor-Traktographie; DTI, Diffusions-Tensor-Imaging; MNI, Montreal Neurological Institute; FA, Fractional Anisotropy.
Fußnoten
- ^ www.fmrib.ox.ac.uk/fsl, Analysis Group, FMRIB, Oxford, UK.
- ^ www.mricro.com, Chris Rorden, CA, USA.
Breier, J. I., Hasan, K. M., Zhang, W., Men, D., und Papanicolaou, A. C. (2008). Sprachstörungen nach Schlaganfall und Schädigung der weißen Substanz mit Hilfe der Diffusions-Tensor-Bildgebung. AJNR Am. J. Neuroradiol. 29, 483-487. doi: 10.3174/ajnr.a0846
PubMed Abstract | CrossRef Full Text | Google Scholar
Duffau, H., Capelle, L., Sichez, N., Denvil, D., Lopes, M., Sichez, J. P., et al. (2002). Intraoperative Kartierung der subkortikalen Sprachbahnen mittels direkter Stimulationen. Brain 125, 199-214. doi: 10.1093/brain/awf016
PubMed Abstract | CrossRef Full Text | Google Scholar
Hong, J. H., Kim, S. H., Ahn, S. H., and Jang, S. H. (2009). Die anatomische Lage des Fasciculus arcuatus im menschlichen Gehirn: eine Diffusions-Tensor-Traktographie-Studie. Brain Res. Bull. 28, 52-55. doi: 10.1016/j.brainresbull.2009.05.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosomi, A., Nagakane, Y., Yamada, K., Kuriyama, N., Mizuno, T., Nishimura, T., et al. (2009). Die Beurteilung des Fasciculus arcuatus mit Diffusions-Tensor-Traktographie kann die Prognose der Aphasie bei Patienten mit Infarkten der linken mittleren Hirnarterie vorhersagen. Neuroradiology 51, 549-555. doi: 10.1007/s00234-009-0534-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, S. H. (2013). Diffusion Tensor Imaging Studien zum Arcuate Fasciculus bei Schlaganfallpatienten: ein Überblick. Front. Hum. Neurosci. 7:749. doi: 10.3389/fnhum.2013.00749
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, H., van Zijl, P. C., Kim, J., Pearlson, G. D., and Mori, S. (2006). DtiStudio: Ressourcenprogramm für Diffusionstensorberechnung und Faserbündelverfolgung. Comput. Methods Programs Biomed. 81, 106-116. doi: 10.1016/j.cmpb.2005.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, S. H., and Jang, S. H. (2013). Vorhersage des Aphasieergebnisses unter Verwendung der Diffusionstensortraktographie für den Arcuate Fasciculus bei Schlaganfall. AJNR Am. J. Neuroradiol. 34, 785-790. doi: 10.3174/ajnr.a3259
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z., Peck, K. K., Brennan, N. P., Jenabi, M., Hsu, M., Zhang, Z., et al. (2013). Diffusionstensor-Traktographie des Fasciculus arcuatus bei Patienten mit Hirntumoren: Vergleich zwischen deterministischen und probabilistischen Modellen. J. Biomed. Sci. Eng. 6, 192-200. doi: 10.4236/jbise.2013.62023
PubMed Abstract | CrossRef Full Text | Google Scholar
Marchina, S., Zhu, L. L., Norton, A., Zipse, L., Wan, C. Y., and Schlaug, G. (2011). Beeinträchtigung der Sprachproduktion in Abhängigkeit von der Läsionsbelastung des linken Fasciculus arcuatus. Stroke 42, 2251-2256. doi: 10.1161/STROKEAHA.110.606103
PubMed Abstract | CrossRef Full Text | Google Scholar
Propper, R. E., O’Donnell, L. J., Whalen, S., Tie, Y., Norton, I. H., Suarez, R. O., et al. (2010). Eine kombinierte fMRI- und DTI-Untersuchung der funktionellen Sprachlateralisierung und der Struktur des Fasciculus arcuatus: Auswirkungen von Grad und Richtung der Handpräferenz. Brain Cogn. 73, 85-92. doi: 10.1016/j.bandc.2010.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Rilling, J. K., Glasser, M. F., Preuss, T. M., Ma, X., Zhao, T., Hu, X., et al. (2008). Die Entwicklung des Fasciculus arcuatus mit vergleichender DTI. Nat. Neurosci. 11, 426-428. doi: 10.1038/nn2072
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E., Johansen-Berg, H., et al. (2004). Fortschritte in der funktionellen und strukturellen MR-Bildanalyse und Implementierung als FSL. Neuroimage 23, S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Tak, H. J., and Jang, S. H. (2014). Beziehung zwischen Aphasie und Arcuate Fasciculus bei chronischen Schlaganfallpatienten. BMC Neurol. 14:46. doi: 10.1186/1471-2377-14-46
PubMed Abstract | CrossRef Full Text | Google Scholar
Thottakara, P., Lazar, M., Johnson, S. C., and Alexander, A. L. (2006). Anwendung von Brodmann’s Area Templates für die ROI-Auswahl in Traktographie-Studien der weißen Substanz. Neuroimage 29, 868-878. doi: 10.1016/j.neuroimage.2005.08.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Wakana, S., Jiang, H., Neage-Poetscher, L. M., van Zijl, P. C., and Mori, S. (2004). Faserbahnbasierter Atlas der Anatomie der menschlichen weißen Substanz. Radiology 230, 77-87. doi: 10.1148/radiol.2301021640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Nagakane, Y., Mizuno, T., Hosomi, A., Nakagawa, M., und Nishimura, T. (2007). MR-Traktographie zur Darstellung einer Schädigung des Fasciculus arcuatus bei einem Patienten mit Aphasie der Leitungsbahnen. Neurology 68:789. doi: 10.1212/01.wnl.0000256348.65744.b2
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamao, Y., Matsumoto, R., Kunieda, T., Arakawa, Y., Kobayashi, K., Usami, K., et al. (2014). Intraoperative Kartierung des dorsalen Sprachnetzwerks durch elektrische Einzelimpulsstimulation. Hum. Brain Mapp. 35, 4345-4361. doi: 10.1002/hbm.22479
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhao, Y., Chen, X., Wang, F., Sun, G., Wang, Y., Song, Z., et al. (2012). Integration der diffusionstensorbasierten Fasernavigation des Arcuate fasciculus und der intraoperativen MRT in die Gliomchirurgie. J. Clin. Neurosci. 19, 255-261. doi: 10.1016/j.jocn.2011.03.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Schreibe einen Kommentar