Eine Meta-Analyse von Metronidazol und Vancomycin zur Behandlung von Clostridium difficile-Infektionen, stratifiziert nach Schweregrad der Erkrankung | The Brazilian Journal of Infectious Diseases
On Januar 20, 2022 by adminEinführung
Clostridium difficile-Infektionen (CDI) sind in der Gesundheitsversorgung in den Industrieländern weit verbreitet1 und können zu schwerwiegenden Komplikationen, längeren Krankenhausaufenthalten und zusätzlichen medizinischen Kosten führen.2 In den letzten 15 Jahren war in Europa, Kanada und den Vereinigten Staaten ein deutlicher Anstieg der Inzidenz- und Mortalitätsrate von CDI zu verzeichnen. Dieser Anstieg war hauptsächlich auf das Auftreten eines neuen, hypervirulenten Stammes von BI/NAP1/027 zurückzuführen, der 2003 in Nordamerika bzw. 2005 in Europa auftauchte. Die Daten aus 28 kommunalen Krankenhäusern im Süden der USA deuten darauf hin, dass C. difficile den Methicillin-resistenten Staphylococcus aureus als häufigste Ätiologie von Infektionen im Zusammenhang mit dem Gesundheitswesen abgelöst hat.3 Metronidazol und Vancomycin sind die am häufigsten verwendeten Antibiotika für CDI, die in der Vergangenheit als ähnlich wirksam galten.4,5 Im Jahr 1995 empfahlen die US-amerikanischen Zentren für Krankheitskontrolle und -prävention (Centers for Disease Control and Prevention), den Einsatz von Vancomycin in Krankenhäusern einzuschränken, da es zu einem Anstieg der Prävalenz von Vancomycin-resistenten Enterokokken (VRE) beitragen könnte.6 Seitdem wurde Metronidazol in der Regel als Erstlinientherapie für CDI eingesetzt. Mit dem Auftreten und der Prävalenz des hypervirulenten Stammes von C. difficile (BI/NAP1/027) sind die Infektionen schwerer geworden, und der Vergleich von Metronidazol und Vancomycin wurde neu bewertet,7,8 insbesondere bei der Behandlung von Patienten mit schwerer CDI. Zar et al. führten die erste prospektive, randomisierte, doppelblinde, placebokontrollierte, einzentrische Studie zum Vergleich von Metronidazol und Vancomycin bei CDI durch. Die Ergebnisse zeigten, dass Metronidazol und Vancomycin gleich wirksam waren, Vancomycin jedoch bei schweren CDI-Patienten überlegen war.9 Ihre Ergebnisse waren von enormer Bedeutung und führten zu Vorschlägen für die Aktualisierung klinischer Praxisleitlinien. In den Leitlinien wurde empfohlen, Metronidazol bei leichter bis mittelschwerer CDI und Vancomycin bei schwerer CDI zu verwenden, wobei die Schwere der Symptome ausschlaggebend war.10-13 In einer Studie von Zar et al, 22 Teilnehmer wurden jedoch von der Analyse ausgeschlossen, und bei einer strengen ITT-Analyse aller 82 zufällig zugewiesenen Patienten mit schwerer Erkrankung war die anfängliche Heilungsrate zwischen Vancomycin und Metronidazol nicht signifikant unterschiedlich (79 % vs. 66 %, p=0,22).3,14 Anschließend berichteten Le et al. über eine höhere klinische Ansprechrate bei Patienten mit schwerer Erkrankung unter Vancomycin, aber nur eine Minderheit der Patienten hatte Vancomycin erhalten (n=8).15 Kürzlich berichteten Johnson et al. über ähnliche klinische Erfolgsraten bei Patienten mit schwerer CDI, die mit Vancomycin oder Metronidazol behandelt wurden, aber Metronidazol war bei allen CDI-Patienten Vancomycin unterlegen.16 Darüber hinaus wiesen Pepin et al. darauf hin, dass der Verlust der Überlegenheit von Vancomycin gegenüber Metronidazol mit dem Aufkommen von NAP1/027 zusammenfiel.17 Daher führten wir eine Metaanalyse durch, bei der die Patienten nach dem Schweregrad der Erkrankung stratifiziert wurden, um die Wirksamkeit von Metronidazol im Vergleich zu Vancomycin zu untersuchen und zu prüfen, welcher Wirkstoff bei der Behandlung einer leichten oder schweren Erkrankung überlegen war.
Materialien und MethodenDatenquellen
Zur Identifizierung der relevanten Studien wurde eine systematische Literatursuche in MEDLINE über Pubmed (1978 bis 31. Oktober 2014), Embase (1978 bis 31. Oktober 2014) und das Cochrane Central Register of Controlled Trials (Cochrane Library) durchgeführt. Die wichtigsten Suchbegriffe waren „metronidazole and vancomycin and clostridium difficile“; „metronidazole and vancomycin and pseudomembrannous colitis“; „metronidazole and vancomycin and antibiotic associated diarrhea“. Alle Referenzen der ursprünglich identifizierten Artikel, einschließlich der relevanten Übersichtsarbeiten, wurden von Hand durchsucht und überprüft. Abstracts von wissenschaftlichen Konferenzen, die uns nicht zugänglich waren, wurden nicht durchsucht.
Studienauswahl
Zwei Gutachter (X.ZH.D und N.B.) durchsuchten unabhängig voneinander die Artikel und prüften die relevanten Studien für die weitere Bewertung. Eine Studie wurde als geeignet angesehen, wenn es sich um eine RCT oder eine prospektive Kohortenstudie handelte, wenn sie erwachsene Patienten mit CDI, einschließlich leichter und/oder schwerer Erkrankung, einschloss, wenn sie die Sicherheit oder Wirksamkeit von Metronidazol und Vancomycin untersuchte und wenn sie spezifische Daten zu klinischer und mikrobiologischer Heilung, Sterblichkeit und unerwünschten Ereignissen berichtete. Es wurden sowohl verblindete als auch unverblindete Studien sowie randomisierte und nicht-randomisierte Designs berücksichtigt. Experimentelle Studien, die auf pharmakokinetischen oder pharmakodynamischen Variablen basieren, wurden ausgeschlossen. Klinische Studien, die eine Kombinationstherapie mit Arzneimitteln beinhalteten, wurden ebenfalls ausgeschlossen.
Qualitative Bewertung
Die Bewertung der methodischen Qualität der in die Meta-Analyse einbezogenen RCTs und Kohortenstudien wurde unabhängig voneinander von zwei Gutachtern (X.ZH.D und N.B.) anhand der von Downs und Black entwickelten Checkliste vorgenommen.18 Dieses Instrument bewertete sowohl randomisierte als auch nicht-randomisierte Studien und lieferte sowohl eine Gesamtbewertung der Studienqualität als auch ein Profil von Punkten für die Bewertung der Qualität der Berichterstattung, der externen Validität, der internen Validität (Verzerrung, Verwechslung) und der Aussagekraft. Qualitativ hochwertige Studien erhielten 15 oder mehr Punkte, während Studien von geringer Qualität 14 oder weniger Punkte erhielten.
Datenextraktion
Zwei Gutachter extrahierten unabhängig voneinander die Daten aus jeder Studie mit einem vorgefertigten Überprüfungsformular. Im Falle von Unstimmigkeiten zwischen den beiden Gutachtern extrahierte ein dritter Gutachter die Daten, bis ein Konsens erzielt wurde. Die aus jeder Studie extrahierten Daten waren: (i) Jahr der Veröffentlichung; (ii) Patientenpopulation; (iii) Anzahl der Patienten; (iv) verwendete antimikrobielle Mittel und Dosierungen; (v) klinische und mikrobiologische Ergebnisse; und (vi) Gesamtmortalität. Wir verwendeten eine ITT-Analyse, die alle zufällig zugewiesenen Patienten einschließt.
Analysierte Ergebnisse
Als Ergebnismaße für diese Meta-Analyse wurden die anfängliche klinische Heilung, die anhaltende Heilung, die mikrobiologische Heilung, das Wiederauftreten und die Gesamtmortalität verwendet. Wir verwendeten die in den einzelnen Studien angegebene Definition der klinischen Erstheilung und des Rezidivs und erfassten die Unterschiede zwischen den Studien. Die Ergebnisse wurden auch auf der Grundlage der folgenden Populationen analysiert: (i) alle Patienten, einschließlich leichter und schwerer CDI; (ii) Patienten mit leichter CDI; (iii) Patienten mit schwerer CDI; und (iv) Patienten mit pseudomembranöser Kolitis (PMC).
Datenanalyse und statistische Methoden
Statistische Analysen wurden mit dem Programm Review Manager, Version 5.2 (Cochrane Collaboration) durchgeführt. Die Heterogenität zwischen den Studien wurde mit dem χ2-Test für Heterogenität (p
0,05 wurde als Hinweis auf signifikante Heterogenität definiert) und dem I2-Maß für Inkonsistenz bewertet. Die gepoolten Risikoverhältnisse (RRs) und 95%-Konfidenzintervalle (CIs) für die Ergebnisse wurden mit dem Modell mit festem Effekt (FEM) berechnet, wenn keine statistisch signifikante Heterogenität zwischen den eingeschlossenen Studien bestand. Andernfalls wurde das Random-Effekt-Modell (REM) verwendet. ErgebnisseAusgewählte klinische Studien
Das Flussdiagramm (Abb. 1) zeigt den detaillierten Screening- und Auswahlprozess für die in diese Meta-Analyse einbezogenen Studien. Bei der Literatursuche wurden 2945 Abstracts gefunden. Wir erhielten 47 vollständige Arbeiten zur detaillierten Auswertung. Von den 41 ausgeschlossenen Studien wurden drei Artikel ausgeschlossen, weil sie Teil von RCTs waren, die bereits in dieser Metaanalyse enthalten waren, eine Studie wurde ausgeschlossen, weil es sich um eine pharmakokinetische Studie handelte,19 andere Studien wurden aufgrund unterschiedlicher Studiendesigns ausgeschlossen, wie z. B. fehlende Kontrollschemata, Kombination mit anderen Antibiotika,20,21 unterschiedliche Ergebnisse,22 oder unterschiedliche Patiententypen,23 usw. So wurden schließlich sechs Studien in diese Meta-Analyse aufgenommen: zwei Kohortenstudien15,24 und vier RCTs.4,5,9,16
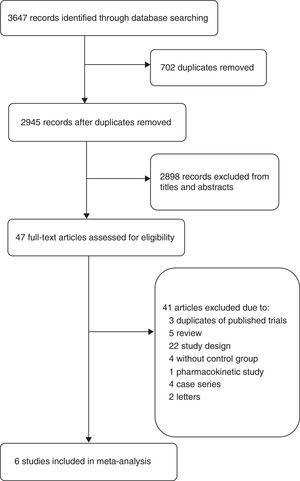
Flussdiagramm der eingeschlossenen Studien.
Studienmerkmale
Die wichtigsten Merkmale der analysierten Studien sind in Tabelle 1 dargestellt. Die eingeschlossenen Studien waren von hoher Qualität (zwei RCTs hatten einen Score von 23, zwei einen Score von 20 und zwei Kohortenstudien einen Score von 17). Zwei RCTs wurden im randomisierten, doppelblinden und placebokontrollierten Design durchgeführt,9,16 während die anderen beiden nur randomisiert waren.4,5 Drei Studien wurden in den Vereinigten Staaten durchgeführt,4,9,15 zwei Studien wurden in Österreich durchgeführt,5,24 während eine einzige Studie, die zwei RCTs umfasste, in den Vereinigten Staaten bzw. in Europa durchgeführt wurde.16 Die Definition von CDI, die anfängliche klinische Heilung und das Wiederauftreten sind in der ergänzenden Tabelle 1 dargestellt. Die Definition von CDI umfasste immer einen Test auf C. difficile-Toxin, Mikroorganismen oder PMC in Kombination mit Durchfall. Die Definitionen von Durchfall variierten jedoch leicht, aber die meisten Studien bezogen sich auf Durchfall als ungeformten Stuhlgang, der mindestens dreimal innerhalb von 24 Stunden auftrat.5,9,15,16 Die Ergebnisse der anfänglichen klinischen Heilung und des Wiederauftretens wurden in allen Studien mit leicht unterschiedlichen Definitionen angegeben. Fünf Studien4,5,9,15,16 betrachteten beispielsweise eine klinische Erstheilung als gegeben, wenn die Diarrhöe innerhalb von 6-8 Behandlungstagen verschwand, während Zar9 und Wenisch5 ein negatives Ergebnis einer C.-difficile-Toxin- oder C-reaktives-Protein-Messung einbeziehen. Die meisten betrachteten einen Rückfall, wenn die Symptome erneut auftraten und/oder mikrobiologisch positive Testergebnisse während der Nachbeobachtungszeit von 21-30 Tagen nach dem anfänglichen Abklingen der Symptome bestätigt wurden.4,5,9,15,16 Nachhaltige Heilung wurde als klinische Heilung ohne Rückfall während der Nachbeobachtungszeit definiert, die als anfängliche klinische Heilung minus Rückfälle berechnet wurde. Die von Wenisch24 berichtete Heilung wurde als anhaltende Heilung betrachtet. Patienten mit mittelschwerer CDI in der Studie von Johnson et al. wurden als schwer erkrankt eingestuft, während alle Patienten in der Studie von Wenisch et al. als leicht erkrankt eingestuft wurden, basierend auf der Bewertung des Schweregrads der CDI in den Studien von Zar9 und den Leitlinien.11 Darüber hinaus gaben Wenisch et al. die Behandlungszuweisung von sieben Patienten, die aus allen Gruppen ausschieden, nicht an.5 Johnson et al. berichteten, dass in die Analyse alle randomisierten Patienten einbezogen wurden, die mindestens eine Dosis Antibiotika erhielten und nach der Dosis bewertet wurden,16 was die ITT-Ergebnisse beeinflusst haben könnte.
Ergänzende Tabellen zu diesem Artikel finden Sie in der Online-Version unter http://dx.doi.org/10.1016/j.bjid.2015.03.006.
Initiale klinische Heilung
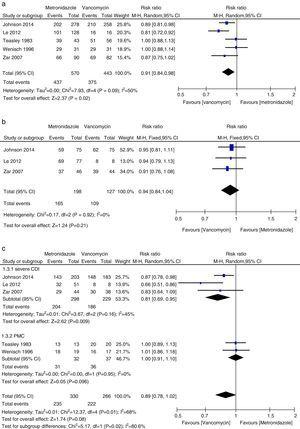
Meta-Analyse der anfänglichen klinischen Heilungsraten im Vergleich von Metronidazol und Vancomycin für alle CDI, leichte CDI, schwere CDI und PMC.
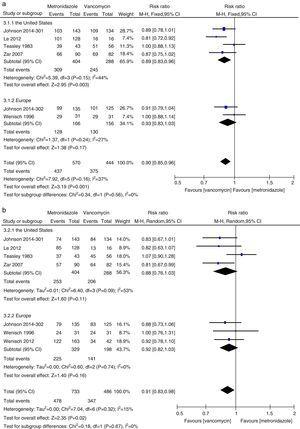
Meta-Analyse der anfänglichen klinischen Heilung und der anhaltenden Heilungsraten im Vergleich zwischen Metronidazol und Vancomycin für alle CDI-Patienten aus den Vereinigten Staaten und Europa.
Nachhaltige Heilung Rückfallrate Mikrobiologische Heilung
Zwei relevante RCTs lieferten mikrobiologische Heilungsraten, definiert als negative Ergebnisse der Nachuntersuchung der Stuhlkultur und des Zytotoxin-Assays auf C. difficile bei klinisch symptomlosen behandelten Patienten.4,5 Hinsichtlich der mikrobiologischen Heilung war die Metronidazol-Therapie ebenso wirksam wie die Vancomycin-Therapie (161 Patienten, FEM, RR=0,88, 95% CI=0,64-1,21, p=0,43, Abb. 6).

Meta-Analyse der mikrobiologischen Heilung im Vergleich zwischen Metronidazol und Vancomycin bei CDI.
All-cause death rate
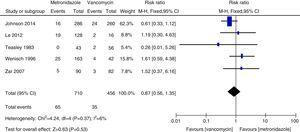
Meta-Analyse der Gesamttodesrate im Vergleich zwischen Metronidazol und Vancomycin bei CDI.
Diskussion
CDI ist ein ernstes Problem im Gesundheitswesen mit weltweit steigender Inzidenz, das erhebliche Morbidität und Mortalität verursachen kann.25 Die Sterblichkeitsraten bei Patienten mit schwerer CDI liegen zwischen 9 % und 25 %; mehr als die Hälfte dieser Todesfälle sind auf CDI zurückzuführen.14,26 Es ist besonders wichtig, Patienten mit schwerer CDI mit einer geeigneten antimikrobiellen Therapie zu behandeln.
In dieser Meta-Analyse haben wir festgestellt, dass Vancomycin Metronidazol in Bezug auf die anfängliche klinische Heilung und die anhaltende Heilung bei CDI-Patienten überlegen war. Die mikrobiologischen Heilungsraten waren unter Metronidazol-Therapie numerisch niedriger als unter Vancomycin, obwohl der Unterschied nicht signifikant war. Die Autoren eines Positionspapiers aus dem Jahr 2011 kamen in ihrer gepoolten Analyse zu dem Ergebnis, dass die anfänglichen klinischen Heilungsraten mit Metronidazol und Vancomycin, den am häufigsten verwendeten Wirkstoffen, gleich hoch sind.27,28 Diese Inkonsistenz ist vor allem auf die unterschiedlichen eingeschlossenen Studien in den einzelnen systematischen Übersichten zurückzuführen. Wir haben drei weitere Studien in die aktuelle Meta-Analyse einbezogen.15,16,24 Bei der Analyse der Daten nach dem Schweregrad der CDI zeigte sich, dass die Behandlung mit Vancomycin oder Metronidazol bei Patienten mit leichter Erkrankung keine Unterschiede aufwies. Allerdings waren die klinischen Heilungs- und Dauerheilungsraten mit Vancomycin bei Patienten mit schwerer CDI deutlich höher als in der Metronidazol-Gruppe. Die Wirksamkeit von Vancomycin und Metronidazol bei Patienten mit PMC ist aufgrund der geringen Zahl der untersuchten Patienten nicht ausreichend belegt. PMC wurde als Marker für eine schwere Erkrankung verwendet.12 Wenn schwere CDI-Patienten PMC-Patienten einschlossen, wurde kein signifikanter Unterschied zwischen der Metronidazol- und der Vancomycin-Therapie festgestellt. Obwohl kein statistischer Unterschied festgestellt wurde, zeigte sich in der Vancomycin-Gruppe eine starke Tendenz zu höheren anfänglichen klinischen Heilungsraten und anhaltenden Heilungsraten, während dies bei Patienten mit leichter CDI nicht der Fall war. Somit war Vancomycin bei schweren CDI-Patienten dem Metronidazol überlegen. Venugopal et al. wiesen nach, dass Patienten mit schwerer CDI eher zu Vancomycin wechselten, was darauf hindeutet, dass diese Patienten schlecht auf Metronidazol ansprachen.29 Diese Ergebnisse wurden in der aktuellen Meta-Analyse bestätigt. Die Behandlungsergebnisse mit Metronidazol waren schlecht, weil die Durchblutung des Dickdarms bei Patienten mit schwerer Erkrankung vermindert sein könnte, was zu einer geringeren Transudation von Metronidazol in das Lumen führte.30,31 Darüber hinaus wurde Fidaxomicin vor kurzem für die Behandlung von CDI zugelassen und kann bei Versagen von Vancomycin oder Metronidazol als sekundäres Mittel eingesetzt werden, da Fidaxomicin in Stuhlproben, die bis zu fünf Tage nach einer Einzeldosis entnommen wurden, nachweisbar blieb.32 In einer Metaanalyse zeigte Fidaxomicin ähnliche klinische Heilungsraten wie Vancomycin und eine signifikante Verringerung der Rezidivrate sowohl bei schweren als auch bei nicht-schweren CDI-Patienten.33 Daher ist orales Vancomycin für die Erstbehandlung schwerer CDI das Mittel der ersten Wahl; Alternativ kann auch orales Fidaxomicin verwendet werden.
Die Rezidivraten von Vancomycin und Metronidazol stimmten im Allgemeinen mit früheren Daten überein, und es wurde kein signifikanter Unterschied festgestellt.27,28 Allerdings war Vancomycin sowohl bei allen CDI-Patienten als auch bei Patienten mit schwerer CDI mit niedrigeren Rezidivraten verbunden als Metronidazol. Unsere Studie deutet darauf hin, dass die Gesamtsterblichkeitsrate bei allen CDI-Patienten zwischen Vancomycin und Metronidazol nicht signifikant unterschiedlich war. Die Gesamtmortalitätsrate aller CDI-Patienten lag bei 100/1166 (8,5 %), was niedriger ist als eine europäische Studie, die eine Mortalitätsrate für alle Fälle von 101/455 (22 %) nach drei Monaten ergab.1
Die Ergebnisse der vorliegenden Meta-Analyse müssen vor dem Hintergrund möglicher Einschränkungen betrachtet werden. Erstens hat sich die Epidemiologie von C. difficile rasch verändert, wobei in diesen Ländern ein größerer Anteil an schweren und rezidivierenden Fällen auftritt als früher berichtet.1 Dies könnte zu Unterschieden in den Studienpopulationen führen. Zweitens sind in den letzten zehn Jahren neue Methoden für die CDI-Diagnose entwickelt worden. Der Einsatz empfindlicherer und schnellerer Tests für die CDI-Diagnose ist für die klinische Behandlung der Patienten von entscheidender Bedeutung. Obwohl die diagnostischen Kriterien in einigen Fällen nicht so streng waren, unterschied sich das Ansprechen auf die Behandlung nicht wesentlich innerhalb eines einzelnen Medikamentenregimes oder zwischen verschiedenen Medikamenten.4 Drittens: Da diese Meta-Analyse eine relativ kleine Anzahl von Studien, insbesondere RCTs, einschloss, könnte die Genauigkeit der Schätzungen beeinträchtigt worden sein. Viertens waren die Prüfer in den vier Studien nicht für die Zuteilung der Behandlung verblindet, was zu einer Verzerrung der berichteten Wirksamkeitsergebnisse geführt haben könnte. Fünftens wurde in den meisten eingeschlossenen Studien nicht sichergestellt, dass alle Fälle von Durchfall bei den eingeschlossenen Patienten durch C. difficile verursacht wurden, da sie das Vorhandensein anderer Erreger im Stuhl als Ursache von Durchfall nicht ausschlossen.4,5 Sechstens ist der Schweregrad-Score noch nicht ausreichend validiert und wissenschaftlich fundiert und muss nicht nur für die Standardisierung künftiger Studien, sondern auch für die Verwendung in der klinischen Praxis verbessert werden.27,34 Daher müssen die aktuellen Ergebnisse weiter bestätigt werden.
Zusammenfassend lässt sich sagen, dass diese Analysen trotz der Einschränkungen der aktuellen Meta-Analyse darauf hindeuten, dass Vancomycin bei der Behandlung von CDI im Vergleich zu Metronidazol erhebliche Vorteile bietet. Die Patienten vertrugen die beiden Medikamente gut, und die Rückfallraten waren ähnlich. Bei Patienten mit leichter CDI war die Metronidazol-Therapie klinisch ebenso wirksam wie Vancomycin; bei Patienten mit schwerer CDI war Vancomycin wirksamer als Metronidazol. Dieser Unterschied in der Wirksamkeit war in der Untergruppe der schweren CDI am deutlichsten und unterstützt die jüngsten Empfehlungen zur Verwendung von Vancomycin als Erstlinientherapie bei schwerer CDI.
Interessenkonflikte
Die Autoren erklären keine Interessenkonflikte.
Finanzierung
Diese Studie wurde von den Major National Science and Technology Special Projects for New Drug (No. 2012ZX09303004) und der Beijing Municipal Natural Science Foundation (No. 7132168) unterstützt.
Schreibe einen Kommentar