Clostridium difficile “ Grampositive Bakterien “ Pathogen-Profil-Lexikon
On Dezember 21, 2021 by adminClostridium difficile
Clostridium difficile ist ein grampositives, toxinproduzierendes anaerobes Bakterium, das zur Familie der Clostridiaceae der Clostridiales gehört. Obwohl C. difficile streng sauerstoffintolerant ist, kann es unter ungünstigen Bedingungen aerotolerante Endosporen produzieren, die in einer offenen Umgebung jahrelang überdauern können. C. difficile ist ein Kommensalist, der typischerweise in der fäkalen Darmflora eines relativ kleinen Teils der Kinderpopulation vorkommt, wobei die Zahl der Träger mit zunehmendem Alter der Kinder abnimmt (Kelly und LaMont, 1998). Wenn er in geringer Zahl vorkommt, ist dieser Organismus nicht pathogen. Wenn es ihm jedoch gelingt, sich zu kolonisieren und größere Populationen zu bilden, wird seine Pathogenität zur Hauptursache für eine Vielzahl von Dickdarminfektionen.
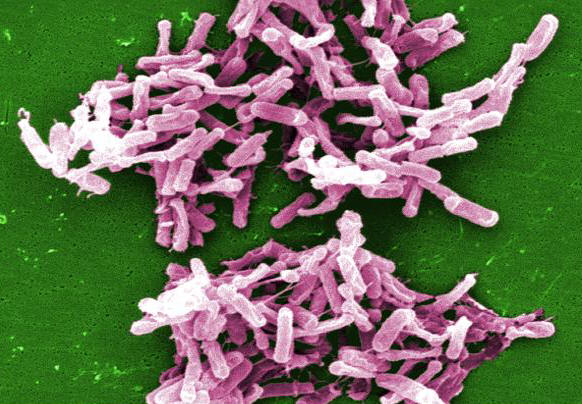
Abbildung 1. Diese mikroskopische Aufnahme zeigt Clostridium-difficile-Bakterien aus einer Stuhlprobenkultur.
Die Infektion mit C. difficile entsteht auf opportunistische Weise; die normale Mikroflora im Darm trägt zur körpereigenen Abwehr von Krankheitserregern bei, und so kommt es in der Regel zu einer Massenbesiedlung mit C. difficile bei Personen, bei denen die typische Darmflora infolge der Einnahme von Antibiotika gestört ist, bei Personen, die immunsupprimiert sind (AIDS- oder Krebspatienten), oder bei Personen, die sogenannte Darmreinigungsmittel einnehmen.
Die inhärente Pathogenität von C. difficile liegt in seiner Fähigkeit, Toxine zu produzieren. Insbesondere produziert dieser Erreger zwei potente Zytotoxine, nämlich Toxin A und Toxin B, die letztendlich zu C. difficile-assoziierten Infektionen und Krankheiten führen (Mylonakis et al., 2001).
Toxin A und Toxin B sind Glucosyltransferasen, die auf die Rho-Familie der GTPase-Enzyme abzielen und diese inaktivieren. Toxin A induziert die Aktin-Depolymerisation durch einen Mechanismus, der mit einer Abnahme der ADP-Ribosylierung der GTP-bindenden Rho-Proteine mit niedriger Molekülmasse korreliert. Ein weiteres Toxin, das binäre Toxin, wurde ebenfalls beschrieben, seine Rolle bei der Krankheit ist jedoch noch nicht vollständig geklärt. Letztendlich führt dies zu einer Verschlechterung der Epithelzellkomponenten und unweigerlich zum Zelltod. Darüber hinaus lösen beide Toxine eine starke zelluläre Entzündungsreaktion und eine massive Freisetzung von Zytokinen aus und aktivieren das enterische Nervensystem, wodurch Neutrophile an die Stelle gelockt werden (Jefferson et al., 1999). Das Gesamtergebnis der Produktion von Toxin A und Toxin B ist eine Schädigung der Dickdarmschleimhaut und eine Entzündung.
C. difficile wird von Mensch zu Mensch über den fäkal-oralen Weg übertragen. Da der Organismus hitzeresistente Sporen bildet, kann er in Krankenhäusern oder Pflegeheimen über lange Zeiträume hinweg überleben. Er kann auf fast jeder Oberfläche im Krankenhaus angezüchtet werden. Sobald die Sporen aufgenommen werden, passieren sie aufgrund ihrer Säureresistenz unversehrt den Magen. Sie keimen im Dickdarm zu vegetativen Zellen, wenn sie Gallensäuren ausgesetzt sind, und vermehren sich.
C. difficile-assoziierte Infektionen beschränken sich in der Regel auf die unteren
Bauchregionen des Gastrointestinaltrakts; die klinischen Manifestationen einer C.difficile-Infektion variieren in Bezug auf den Schweregrad und reichen von Durchfall bis zu einer akuten Entzündung des Dickdarms, die zum Tod führt. Die pseudomembranöse Kolitis (PMC) ist die Erkrankung, die am häufigsten mit C.difficile in Verbindung gebracht wird, da sie in jedem Fall fast ausschließlich durch eine andere Ursache als C.difficile verursacht wird. PMC zeichnet sich durch einen fortschreitenden Durchfall aus, bei dem sich die Dickdarmschleimhaut stark entzündet. Neben Symptomen wie Durchfall, Fieber, Dehnung des Bauches und Schmerzen kommt es zur Bildung von Pseudomembranen. Diese Pseudomembran besteht aus einer Vielzahl von Zellbestandteilen, darunter Fibrin, Schleim, abgestorbene Zelltrümmer und Leukozyten. Pseudomembranen treten in verschiedenen Regionen der Dickdarmwände auf und bilden in fatalen Fällen eine Hülle über die gesamte Dickdarmschleimhaut (Mylonakis et al., 2001).
Die durch C. difficile verursachte pseudomembranöse Kolitis wird mit spezifischen Antibiotika, wie Vancomycin oder Metronidazol, behandelt. Um Komplikationen zu vermeiden, beginnen Ärzte die Behandlung oft auf der Grundlage des klinischen Bildes, bevor endgültige Ergebnisse vorliegen. Die Kenntnis der lokalen Epidemiologie der Darmflora in einer bestimmten Einrichtung kann die Therapie leiten. Darüber hinaus ist eine orale Rehydratationstherapie nützlich, um die Flüssigkeit während der Dauer der Diarrhöe zu erhalten. Interessanterweise sind mehrere in Krankenhäusern üblicherweise verwendete Desinfektionsmittel möglicherweise unwirksam gegen C. difficile-Sporen und können sogar die Sporenbildung fördern. Desinfektionsmittel, die Bleichmittel enthalten, sind jedoch wirksam bei der Abtötung der Organismen und sollten ständig als Desinfektionsmittel verwendet werden.
Laboranbauten und Gram-Färbeverfahren werden als zu unspezifisch angesehen, um C. difficile in klinischen Situationen zu identifizieren, da es morphologisch anderen Clostridienarten ähnelt, die die normale Mikroflora des Dickdarms bilden. Typische diagnostische Tests selektieren auf das Vorhandensein der Produktion von Toxin A oder Toxin B (Mylonakis et al., 2001). Der Gewebekulturtest zur Bestimmung der Spezifität der Toxin-B-Zytotoxizität ist nach wie vor einer der empfindlichsten und genauesten Tests für die Diagnose. Enzyme-linked immunosorbent assays (ELISAs) sind ebenfalls in der Lage, Toxin A und/oder Toxin B im Stuhl zu identifizieren, die schnell und spezifisch sind und am häufigsten für die klinische Diagnose von vermuteten C. difficile-Infektionen verwendet werden.
Jefferson, K.K., Smith, M.F. Jr., & Bodak, D.A. (1999). Roles of intracellular calcium and NF-kappa B in the Clostridium difficile toxin A-induced up-regulation and secretion of IL-8 from human monocytes. Journal of Immunology, 163: 5183-5191.
Kelly, C.P. & LaMont, T. (1998). Clostridium difficile infection. Annual Review of Medicine, 49: 375-390.
Mylonakis, E., Ryan, E.T., & Calderwood, S.B. (2001). Clostridium difficile-assoziierte Diarrhöe. Archives of Internal Medicine, 161: 525-533.
Schreibe einen Kommentar