Bewertung der Zellgesundheit: Viabilität und Proliferation
On Oktober 11, 2021 by adminTeil I: Viabilitäts- und Proliferationsassays
Lebensfähigkeit und Proliferation
Lebensfähigkeit und Proliferation sind zwei unterschiedliche Eigenschaften von Zellen. Die Lebensfähigkeit ist ein Maß für die Anzahl der lebenden Zellen in einer Population, während die Proliferation ein Maß für die Zellteilung ist. Es ist zu beachten, dass sich nicht alle lebensfähigen Zellen teilen. Obwohl Proliferation ohne weiteres als Lebensfähigkeit interpretiert werden kann, sollte das Fehlen von Proliferation nicht automatisch als Zeichen des Zelltods gewertet werden.
Bestimmung von Lebensfähigkeit und Proliferation
1. Membrandurchlässigkeit
Ein Kennzeichen toter und sterbender Zellen ist der Zusammenbruch der Zell- und Kernmembranen. Viele Lebensfähigkeitstests nutzen dieses Merkmal des Zelltods, um lebensfähige von nicht lebensfähigen Zellen zu unterscheiden.
Polare, zellundurchlässige Nukleinsäure-Farbstoffe wie DAPI, Propidiumiodid (PI) und 7-AAD färben tote Zellen, da diese Farbstoffe nur in Zellen mit beschädigten Membranen eindringen können. PI bindet sowohl RNA als auch DNA, während 7-AAD und DAPI nur mit DNA interagieren. Diese Farbstoffe können in Kombination mit Assays zum Nachweis enzymatischer Aktivität (z. B. die im nächsten Abschnitt behandelten Esterase-Substrate) oder mit zelldurchlässigen Lebensfähigkeitsindikatoren verwendet werden, um lebende und tote Zellen gleichzeitig zu markieren. PI-, DAPI- und 7-AAD-Tests können mit einem Fluoreszenzmikroskop, einem Durchflusszytometer (Abbildung 1) oder einem Mikroplattenlesegerät abgelesen werden.
A.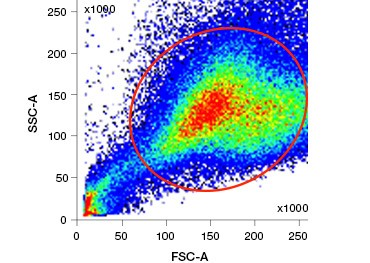
B.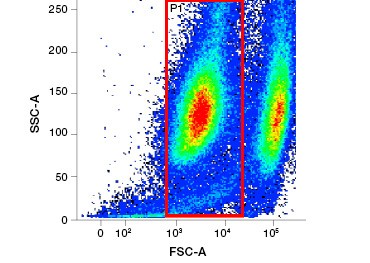
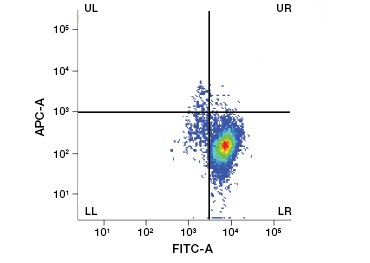
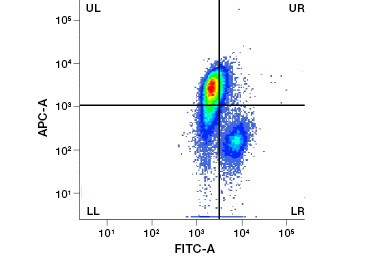
Abbildung 1. Propidiumjodid-Färbung verbessert die Identifizierung von Zellen von Interesse. Die Färbung lebender Zellen mit Hilfe von Vorwärts- und Seitenstreuung reicht möglicherweise nicht aus, um tote Zellen zu entfernen, und unspezifische Bindungen können weiterhin vorhanden sein (A). Die Verwendung von Lebensfähigkeitsfarbstoffen wie Propidiumjodid kann dazu beitragen, unspezifische Bindungen zu beseitigen (B). J774-Makrophagen wurden für CD11b und CD3 angefärbt, wobei der rote Kreis und das Rechteck die Gating-Strategie für lebende Zellen anzeigen.
Das Timing ist bei der Verwendung dieser Farbstoffe von entscheidender Bedeutung, da der Anteil der angefärbten Zellen während der Anfärbung zunimmt, da die Zellen weiter absterben. Es ist zu beachten, dass keiner dieser Farbstoffe fixierbar ist. Für Anwendungen, die eine Fixierung erfordern, sind Ethidiummonoazide oder aminreaktive Proteinfarbstoffe eine ausgezeichnete Wahl.
Zellundurchlässige Proteinfarbstoffe sind eine gute Alternative zu Nukleinsäurefarbstoffen, da sie weniger toxisch sind. Amin-reaktive Farbstoffe sind in einer breiten Palette von Anregungs- und Emissionsspektren erhältlich und ermöglichen daher eine größere Flexibilität bei der Gestaltung von Durchflusszytometrie- und Mikroskopie-Panels als DNA-Farbstoffe. Ein weiterer Vorteil dieser Proteinfarbstoffe ist, dass sie fixierbar sind (Abb. 2).
A.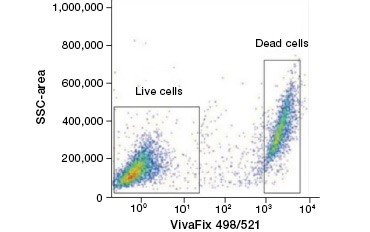
B.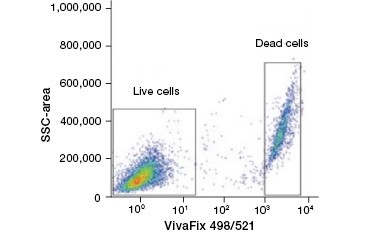
Abb. 2. Proteinfärbungen unterscheiden lebende von toten Zellen. Mit VivaFix™ Cell Viability Assays können lebende und tote Zellpopulationen identifiziert und anschließend in fixierten (A) und unfixierten (B) Zellen mit Hilfe der Durchflusszytometrie analysiert werden.
Eine besondere Überlegung bei der Verwendung des üblichen Proteinfarbstoffs Trypanblau ist, dass dieser Farbstoff lebensfähige Zellen im Laufe der Zeit zellspezifisch anfärbt. Daher ist es wichtig, die Trypanblau-Protokolle für jeden Zelltyp und jedes Experiment zu optimieren.
Alle diese Farbstoffe können an einzelnen Zellen und Geweben verwendet und mit Hilfe der Fluoreszenzmikroskopie oder der Durchflusszytometrie ausgewertet werden, obwohl die Trypanblau-Färbung üblicherweise durch manuelles Zählen der Zellen mit einem Hämozytometer und einem Mikroskop ausgewertet wird.
Im Gegensatz zu zellundurchlässigen Nukleinsäurefärbemitteln diffundieren zelldurchlässige Nukleinsäurefärbemittel wie Acridinorange leicht durch Zellmembranen und färben so die DNA lebensfähiger Zellen. Nicht lebensfähige Zellen werden nicht effizient angefärbt, da ihre beschädigten Membranen den Farbstoff leicht aus ihnen herausdiffundieren lassen. Acridinorange ist ein Dual-Fluoreszenz-Farbstoff, der grün fluoresziert, wenn er an dsDNA gebunden ist, und rot fluoresziert, wenn er an ssDNA und RNA gebunden ist. Bei der Verwendung von Acridinorange als DNA-Bindungsfarbstoff ist zu beachten, dass es kondensiertes Chromatin nicht effizient bindet. Wie in Abschnitt 6 erläutert, kann dieser Farbstoff auch verwendet werden, um die Fähigkeit der Zellen zu beurteilen, den sauren pH-Wert in den Lysosomen aufrechtzuerhalten, ein weiterer Indikator für die Lebensfähigkeit der Zellen. Zellpermeable Nukleinsäure-Farbstoffe können zur Identifizierung und Quantifizierung lebensfähiger Zellpopulationen durch Mikroskopie, Durchflusszytometrie oder Mikroplattentests verwendet werden.
Zellimpermeable und -permeable Farbstoffe können in Kombination mit fluoreszenzmarkierten Antikörpern gegen Proteine von Interesse verwendet werden, so dass es einfach ist, entscheidende Lebensfähigkeitskontrollen in jedes Experiment einzubeziehen. Ein wichtiger Aspekt bei der Verwendung dieser Farbstoffe zur Beurteilung der Membranintegrität ist, dass verschiedene Zelltypen unterschiedliche Membranpermeabilitätseigenschaften aufweisen. Einige zellundurchlässige DNA-Farbstoffe färben beispielsweise tote eukaryotische Zellen problemlos an, sind aber nicht in der Lage, Prokaryoten mit geschädigten Membranen zu färben.
Die Membranintegrität kann auch mit Hilfe enzymatischer Assays beurteilt werden. Ein beliebter Test ist die Bestimmung der Freisetzung des zytoplasmatischen Enzyms Laktatdehydrogenase (LDH) in das Kulturmedium beim Zelltod. LDH-Kolorimetrie-Assays können im Mikroplattenformat durchgeführt und mit einem ELISA-Mikroplattenlesegerät abgelesen werden.
Der Membranabbau kann auch mit Chromfreisetzungsassays gemessen werden. Hier werden die Zellen vor der experimentellen Behandlung mit 51Cr markiert. Das Chrom bindet sich an zelluläre Proteine und wird beim Zelltod in das Kulturmedium freigesetzt. Durch die Bestimmung der Menge an freiem gegenüber gebundenem 51Cr mit einem Szintillationszähler kann der Zelltod quantitativ gemessen werden. Die Zellen können auch mit Fluoreszenzfarbstoffen vormarkiert werden. Diese Methoden haben manchmal einen hohen Hintergrund aufgrund der spontanen Freisetzung von Markern; sie sind nur für Anwendungen nützlich, die eine Vormarkierung der interessierenden Zellen erlauben.
2. Enzymatische Aktivität
Ein weiterer wichtiger Unterschied zwischen lebensfähigen und nicht lebensfähigen Zellen ist, dass lebensfähige Zellen enzymatisch aktiv sind. Die Esteraseaktivität, die mit Substraten wie Carboxyfluoresceindiacetat (CFDA) gemessen wird, wird üblicherweise als Indikator für die gesamte enzymatische Aktivität verwendet. CFDA ist ein nicht fluoreszierender, zelldurchlässiger Farbstoff, der durch unspezifische intrazelluläre Esterasen, die nur in lebensfähigen Zellen vorhanden sind, zu dem fluoreszierenden Molekül Carboxyfluorescein hydrolysiert wird. Da Carboxyfluorescein negativ geladen ist, wird es in lebensfähigen Zellen nicht kovalent gehalten, was zu grüner Fluoreszenz führt.
CFDA-SE ist ein Derivat von CFDA, das nach der Hydrolyse besser gehalten wird. Sein Produkt, CFSE, hat Succinimidylester-Gruppen, die kovalente Bindungen mit primären Aminen intrazellulärer Proteine eingehen, was eine langfristige Verfolgung der Lebensfähigkeit von Zellen ermöglicht. Da CFSE kovalent in den Zellen verbleibt, ist es ein zuverlässigerer Indikator für die Lebensfähigkeit von Zellen und ein beliebtes Maß für die Zellproliferation, da sich seine Fluoreszenz mit jeder Zellteilung halbiert (Abbildung 3). CFDA-SE wurde durch Proliferationsfarbstoffe verbessert, die eine höhere Zellretention aufweisen, eine bessere Auflösung der Zellteilung bieten und in einem breiten Spektrum von Anregungs- und Emissionsspektren erhältlich sind, um die Einbindung in mehrfarbige Fluoreszenzanwendungen wie die Durchflusszytometrie zu ermöglichen.
A.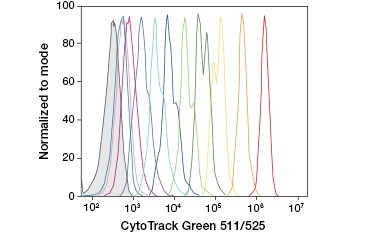
B.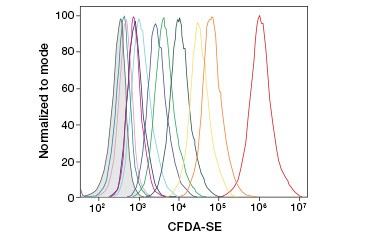
Abb. 3. Verfolgung von Zellgenerationen mittels Durchflusszytometrie. Zehn Zellgenerationen können mit dem CytoTrack™ Green 511/525 Cell Proliferation Assay (A) und bis zu acht mit CFDA-SE (B) aufgelöst werden.
Viele andere fluoreszierende Esterase-Substrate, wie z. B. Calcein-Derivate und BCECF, sind mit unterschiedlichen Eigenschaften erhältlich, einschließlich unterschiedlicher Anregungs-/Emissionsspektren. Da die Fluoreszenz von BCECF pH-empfindlich ist, können auch Änderungen des zytosolischen pH-Wertes verfolgt werden.
Bei Verwendung zelldurchlässiger Esterase-Substrate kann die Lebensfähigkeit durch Fluoreszenzmikroskopie und Durchflusszytometrie bewertet werden. Diese Substrate können auch auf Gewebeproben aufgetragen oder in Mikroplatten-Assays mit hohem Durchsatz verwendet werden.
3. Stoffwechselaktivität
Ein weiteres gängiges Maß für die Lebensfähigkeit von Zellen ist die Stoffwechselaktivität, die mit oxidierbaren und reduzierbaren Sonden bewertet werden kann.
Resazurin ist ein beliebter Oxidations-Reduktions-Indikator (Redox). Dieser zelldurchlässige Farbstoff kann direkt dem Zellkulturmedium zugesetzt werden, was ihn zu einem schnellen und praktischen Assay macht. In stoffwechselaktiven Zellen wird das blaue und schwach fluoreszierende Resazurin zu Resorufin, einem rosa und stark fluoreszierenden Molekül, reduziert. Diese Veränderung kann sowohl mit fluoreszierenden als auch mit kolorimetrischen Assays überwacht werden. Da die Fluoreszenzmenge direkt proportional zur Anzahl der lebenden, atmenden Zellen ist, wird Resazurin häufig zur quantitativen Messung der Lebensfähigkeit von Zellen verwendet. Resazurin ist eine praktische, empfindlichere, stabilere und ungiftige Alternative zu anderen Redoxindikatoren wie den Tetrazoliumsalzen MTT und XTT. Im Gegensatz zu Assays auf der Basis von Tetrazoliumsalzen, die kolorimetrisch sind und nur mit einem Mikroplattenlesegerät abgelesen werden können, können Resazurin-Viabilitätsassays mit Durchflusszytometrie oder Fluoreszenzmikroskopie abgelesen werden. Resazurin und Tetrazoliumsalze sind besonders nützlich für Anwendungen mit hohem Durchsatz, da die Lebensfähigkeit in Mikroplatten mit einem Mikroplattenlesegerät gemessen werden kann (Abbildung 4). XTT wird bei Anwendungen mit höherem Durchsatz häufig MTT vorgezogen, da es im Gegensatz zu MTT einen wasserlöslichen Farbstoff liefert, wodurch ein Solubilisierungsschritt entfällt, der für MTT-Tests entscheidend ist. Resazurin und Tetrazoliumsalze werden am häufigsten zur Bewertung der Lebensfähigkeit von adhärenten Zellen und Zellen in Lösung verwendet.
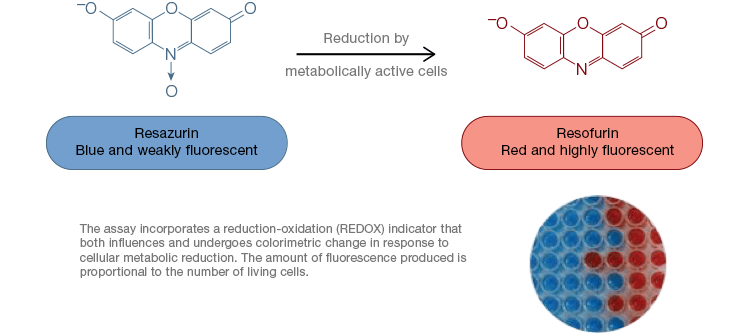
Abb. 4. Ungiftige Resazurin-Oxidationstests sind leicht skalierbar für Anwendungen mit hohem Durchsatz. Die Oxidation von AlamarBlue in stoffwechselaktiven Zellen führt zu einem kolorimetrischen Wechsel von Blau zu Rot sowie zu einer Zunahme der Fluoreszenz.
Dihydrorhodamine, -Calceine und -Fluoresceine sind reduzierte Rhodamin-, -Calcein- und -Fluorescein-Derivate, die zelldurchlässig und farblos sind. Diese Verbindungen werden durch reaktive Sauerstoffspezies, die in lebenden Zellen und Geweben vorhanden sind, leicht zu ihrem fluoreszierenden Ausgangsfarbstoff oxidiert.
Eine andere Klasse von Lebensfähigkeitstests, die die Stoffwechselaktivität messen, sind lumineszierende ATP-Tests. Diese quantifizieren das von den Zellen bei der Lyse freigesetzte ATP. Sie erfordern keine langen Inkubationszeiten, sind äußerst empfindlich und werden in der Regel mit einem Mikroplattenlesegerät abgelesen.
Ein Faktor, der bei der Verwendung von Assays zur Messung der Stoffwechselaktivität zu berücksichtigen ist, ist, dass die Stoffwechselaktivität unter verschiedenen Zellkulturbedingungen unterschiedlich sein kann. Daher müssen geeignete Kontrollen einbezogen werden, um diese Unterschiede zu berücksichtigen.
4. DNA-Synthese/Replikation
Ein weiteres Maß für die Lebensfähigkeit und eine beliebte Methode zur Bewertung der Proliferation ist die Quantifizierung des BrdU-Einbaus in neu synthetisierte DNA. BrdU-haltige DNA wird mit konjugierten BrdU-Antikörpern oder BrdU-Antikörpern in Kombination mit einem konjugierten sekundären Antikörper nachgewiesen (Abbildung 5). Diese Assays ermöglichen eine Vielzahl von Messwerten, da die Antikörper an verschiedene Arten von Indikatoren (Fluorophore, Peroxidasen usw.) gekoppelt werden können. Durch die Markierung spezifischer Zellmarker mit Antikörpern können auch bestimmte proliferierende Populationen unterschieden werden. Die Proben werden nach der Inkubation fixiert und dann mittels Durchflusszytometrie, Fluoreszenzmikroskopie, Immunhistochemie oder Mikroplattenlesegeräten analysiert. Mit Hilfe der Durchflusszytometrie können die Zellen auf der Grundlage ihres Gesamt-DNA-Gehalts der G0/G1-, S- oder G2/M-Phase des Zellzyklus zugeordnet werden. Durch die Verwendung chromogener Peroxidase-Substrate können die Assays ohne Fluorometer abgelesen werden. Und durch die Verwendung von -TdR anstelle von BrdU können diese Assays in ein Radiolabel-Readout umgewandelt werden.
A.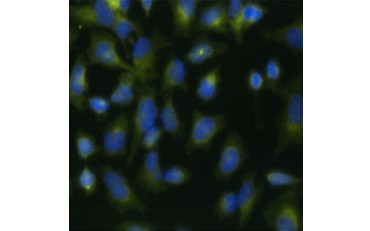
B.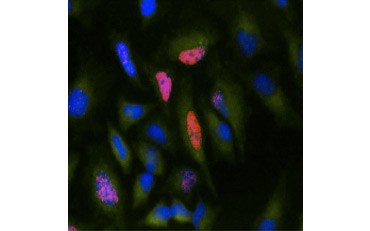
Abb. 5. Visualisierung des BrdU-Einbaus. HeLa-Zellen wurden mit 10 µg BrdU für 1 Stunde behandelt (B) oder unbehandelt gelassen (A). Die Zellen wurden mit dem Maus-Anti-BrdU-Antikörper, Klon Bu20a (MCA2483; 1:25-Verdünnung) angefärbt und als Sekundärantikörper wurde der Ziege Anti-Maus-IgG (H/L) DyLight 549 konjugierte Antikörper (rot) (STAR117D549GA; 1:50-Verdünnung) verwendet. Das Zytoplasma wurde mit Kaninchen-Anti-GAPDH-Antikörper (AHP1628; 1:100-Verdünnung) und Schaf-Anti-Kaninchen-IgG DyLight 488 konjugierter Antikörper (grün) (STAR36D488GA; 1:50-Verdünnung) als Sekundärantikörper gefärbt. PureBlu™ DAPI (1351303) wurde als Kerngegenfärbung verwendet.
5. Expression von Proliferationsmarkern
Es ist bekannt, dass die Expression bestimmter Proteine während der Zellproliferation zunimmt. Ki-67 zum Beispiel wird im Zellkern von sich teilenden Zellen exprimiert, ist aber während G0 und G1 nicht nachweisbar (Abbildung 6). In ähnlicher Weise kann die Histon-H3-Phosphorylierung zur Identifizierung von Zellen in der M-Phase verwendet werden. Andere häufig verwendete Proliferationsmarker sind das Proliferating Cell Nuclear Antigen (PCNA) und Minichromosome Maintenance 2 (MCM2). Mithilfe von Antikörpern gegen diese, andere wichtige Proliferationsmarker oder Zelllinienmarker können mittels ELISA, Durchflusszytometrie, Immunhistochemie, Fluoreszenzmikroskopie und Western Blotting untersucht werden.
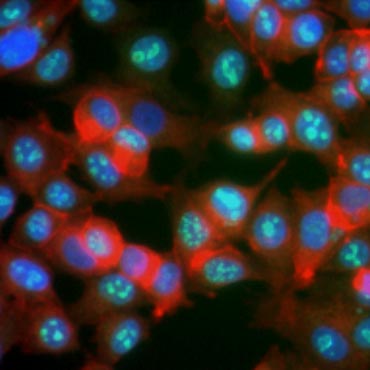
Abbildung 6. Antikörper gegen Ki-67 identifizieren proliferierende Zellen. Färbung von MCF-7-Zellen mit humanem Anti-Ki-67 (HCA006, grün), gegengefärbt mit Phalloidin (rot) und Hoechst (blau).
6. Membranpotential und pH-Wert
Lebende Zellen halten aktiv Ionengradienten über ihre Membranen aufrecht und erzeugen so Transmembranpotentiale. Wenn eine Zelle stirbt, sind diese Ionengradienten gestört. Dies kann mit potentiometrischen Farbstoffen gemessen werden. JC-1 ist ein häufig verwendeter potentiometrischer Farbstoff. In gesunden Zellen lokalisiert sich JC-1 in den Mitochondrien, wo es rot fluoreszierende Aggregate bildet. Nach dem Zusammenbruch des mitochondrialen Membranpotenzials diffundiert JC-1 durch die Zelle und liegt als grün fluoreszierendes Monomer vor. Tetramethylrhodaminethylester (TMRE) und Tetramethylrhodaminmethylester (TMRM) lokalisieren sich wie JC-1 in gesunden Zellen in den Mitochondrien und in sterbenden Zellen im Zytoplasma. Im Gegensatz zu JC-1 zeigen diese Farbstoffe keine Verschiebung in ihren Emissionsspektren. Stattdessen führt die Permeabilisierung der mitochondrialen Außenmembran zu einer Abnahme der roten TMRM/TMRE-Fluoreszenz.
Lebensfähige Zellen sind in der Lage, einen niedrigen pH-Wert in den sauren Organellen der Zelle, wie z. B. dem Lysosom, zu erzeugen und aufrecht zu erhalten. Dies kann mit acidotropen Färbemitteln wie Acridinorange und Neutralrot gemessen werden. Bei der Verwendung von Acridinorange ist zu beachten, dass dieser Farbstoff auch DNA und RNA bindet. Wenn er an Einzelstrang-Nukleotide gebunden ist, fluoresziert Acridinorange rot; wenn er an Doppelstrang-DNA gebunden ist, fluoresziert er grün; und wenn er an DNA im Lysosom gebunden ist, fluoresziert er orange.
Ungeachtet der gewählten Methode ist es von entscheidender Bedeutung, bei der Durchführung der hier beschriebenen Assays geeignete Kontrollen einzubeziehen, da die Versuchsbedingungen und der Zelltyp die Leistung einiger Assays verändern können. Führen Sie immer Positiv- und Negativkontrollen durch. Bei der Verwendung von Sonden in Lösungsmitteln sollten Sie auch Kontrollen mit Vehikel verwenden, um die Auswirkungen des Lösungsmittels zu berücksichtigen. Verwenden Sie anwendungsspezifische Kontrollen, um Faktoren wie Autofluoreszenz in Immunfluoreszenz- und Durchflusszytometrie-Experimenten und Ladekontrollen für Western Blotting zu kontrollieren.
Für Informationen über Bio-Rads Zelllebensfähigkeits- und Proliferationsassays besuchen Sie unsere Zellgesundheitsseite.
Lesen Sie Teil II Bewertung der Zellgesundheit: Apoptose
alamarBlue ist eine Marke von Trek Diagnostic Systems. DyLight ist ein Warenzeichen von Thermo Fisher Scientific.
Schreibe einen Kommentar