Äquivalentmassen von Säuren, Basen und Salzen
On Oktober 4, 2021 by adminWissenschaft >Chemie >Konzept der Atommasse und Äquivalentmasse >Äquivalentmassen von Säuren, Basen und Salzen
In diesem Artikel werden wir die Bestimmung der Äquivalentmasse von Säuren, Basen und Salzen untersuchen.
Äquivalentmasse von Säuren:
Ein Gramm Äquivalentmasse einer Säure ist diejenige Masse einer Säure, die ein Gramm Äquivalentmasse an ersetzbaren Wasserstoffatomen enthält.
Die Äquivalentmasse einer Säure hängt also von den ersetzbaren Wasserstoffatomen ab, die sie pro Mol enthält. Die Anzahl der ersetzbaren Wasserstoffatome in einem Säuremolekül wird als Basizität der Säure bezeichnet.

Abbildung – 1:
Molekulare Masse von HCl = 1 + 35,5 = 36.5

Abbildung – 2:
Molekulare Masse von H2SO4 = 2 + 32 + 64 = 98
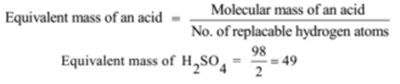
Äquivalente Masse der Base:
Ein Gramm Äquivalentmasse einer Base ist diejenige Masse der Base, die ein Gramm Äquivalentmasse des Hydroxylradikals enthält.
Die Äquivalentmasse einer Base hängt also von der Anzahl der in ihr enthaltenen Hydroxylradikale pro Mol ab. Die Anzahl der in einem Molekül einer Base vorhandenen Hydroxylradikale nennt man die Acidität der Base.

Abbildung – 1:
Molmasse von NaOH = 23 + 16 + 1 = 40

Abbildung – 2:
Molekulare Masse von Ca(OH)2= 40 + (16+1) x 2 = 74

Äquivalent-Masse der Salze:
Äquivalentmasse eines einfachen Salzes ist diejenige Masse desselben, die ein Gramm Äquivalent des Metalls oder eines Restes enthält
Abbildung – 1:
Molekulare Masse von KCl = 39 + 35.5 = 74,5
In diesem Fall enthält KCl 1 Gramm Äquivalent K und 1 Gramm Äquivalent Cl. Hene äquivalente Masse von KCl ist 74,5 / 1 = 74,5.
Abbildung – 2:
Molekulare Masse von AlCl3 = 27 + 35,5 x 3 = 133,5
In diesem Fall enthält AlCl2 1 Gramm Äquivalent von Al und 3 Gramm Äquivalent von Cl. Hene äquivalente Masse von KCl ist 133,5 / 3 = 44,5.
Abbildung – 3:
Äquivalente Masse eines Salzes ist auch diejenige Masse, die sich mit einem Gramm Äquivalent eines anderen Stoffes verbindet.
Um die äquivalente Masse von Na2CO3 zu finden
Na2CO3 reagiert mit HCl wie
Na2CO3 + 2HCl → 2 NaCl + CO2 + H2O
Molekulare Masse von Na2CO3 = 23 x 2 + 12 x 1 + 16 x 3 = 106
Ein Gramm Na2CO3 reagiert mit 2 Gramm HCl. Daher ist die Äquivalentmasse von Na2CO3 106 / 2 = 53.
Äquivalentmasse von Oxidations- und Reduktionsmitteln:

Anmerkung:
Metalle mit variabler Wertigkeit zeigen variable Äquivalentmassen, abhängig von ihrer Wertigkeit in der Verbindung. Zum Beispiel in den Oxiden FeO, Fe2O3 und Fe3O4 sind die äquivalenten Massen von Fe 28,18,6 bzw. 21.
Gramm-Äquivalent:
Die äquivalente Masse, ausgedrückt in Gramm, wird Gramm-Äquivalent-Masse (GEM)
Milliequivalent:
Ein Milliequivalent ist ein Tausendstel einer äquivalenten Masse einer Substanz ist die äquivalente Masse in Milligramm ausgedrückt. Es ist die Einheit, die verwendet wird, um die Konzentration von Elektrolyten in Gewebeflüssigkeiten von Tieren und Pflanzen auszudrücken.
Schreibe einen Kommentar