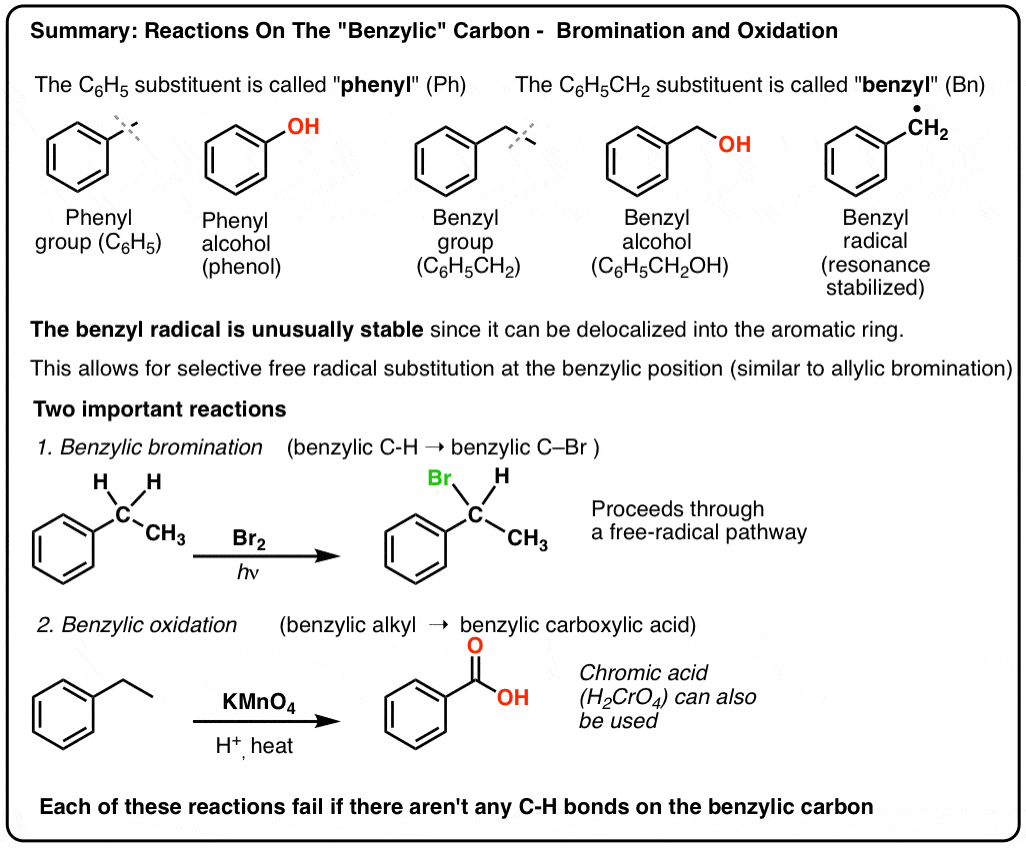
Reaktioner på det “benzyliske” kulstof: Bromering og oxidering
On oktober 12, 2021 by adminKulstoffet, der støder op til en aromatisk ring – det “benzyliske” kulstof – kan deltage i flere nyttige og interessante reaktioner. I dag vil vi give eksempler og mekanismer for to vigtige eksempler: benzylisk bromering og benzylisk oxidation. Her er et hurtigt resumé:
Indholdsfortegnelse
- Alkylgrupper = “Råstof”
- Der er noget særligt ved alkylgrupper, der støder op til en benzenring
- “Phenyl” vs “Benzyl” : Hvad er forskellen?
- Benzylradikaler stabiliseres ved resonans; phenylradikaler stabiliseres ikke.
- Benzyliske (og allyliske) C-H-bindinger er svage i forhold til andre alkyl-C-H-bindinger
- Benzylisk brominering
- Hvornår virker “benzylisk brominering” IKKE?
- Anvendelser af benzylbromering
- Benzylisk oxidation med KMnO4 (eller H2CrO4)
- Benzylisk oxidation kræver en benzylisk C-H-binding
- Hvorfor er dette vigtigt?
- Noter
- Quiz dig selv!
- (Avanceret) Referencer og yderligere læsning
Alkylgrupper = “Grovfoder”
I ernæring er “grovfoder” det, man kalder al den cellulose og de fibre, der er til stede i fødevarer, som bare skyder gennem kroppen uden at blive fordøjet.
Det beskriver stort set alkylgruppernes adfærd i langt de fleste af de reaktioner i organisk kemi, som vi har lært. Deres kemi er “kedelig”. De udgør måske nok molekylets rygrad og overordnede struktur, men deres C-H-bindinger er inaktive i forhold til de fleste reaktionsforhold.
Faktisk er stort set den eneste reaktion af alkylgrupper, som vi behandler i introduktionsundervisningen i organisk kemi, hvis man ikke tæller forbrænding med, fri-radikal substitution. Og selv den reaktion har tendens til at være temmelig uselektiv, især hvis man har at gøre med klorering af frie radikaler.
Vi har set, at en undtagelse fra denne “kedelige” opførsel kan findes i den fritradikale bromering af såkaldte “allyliske” C-H-bindinger . Den “allyliske” position er et kulstof, der er nabo til en dobbeltbinding (ikke et C-H på selve dobbeltbindingen! det er et “vinylic” C-H).
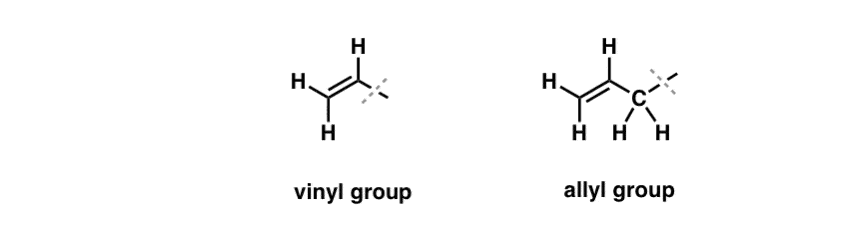
Hvad gør den “allyliske” position så speciel? Allylicradikaler, carbocationer og anioner er betydeligt stabiliseret gennem resonans. Orbitalet i det allyliske radikal, karbokation eller anion kan rette sig ind efter p-orbitalerne i den tilstødende pi-binding, hvilket resulterer i et større “pi-system” og spreder ladningen ud over et større område.
Der er noget særligt ved alkylgrupper, der støder op til en benzenring
Hvad er årsagen til denne lille tur i hukommelsen? Jo, vi har for nylig brugt lidt tid på at gennemgå Friedel-Crafts alkyleringsreaktion, og jeg vil ikke give dig det indtryk, at det er en syntetisk blindgyde at sætte en alkylgruppe på en benzenring.
Alkylgrupper behøver ikke at være inaktive! Ligesom allyliske kulbrinter er alkylgrupper, der støder op til benzenringe, særligt reaktive, og dette kan have alle mulige vigtige anvendelser.
Der er to vigtige reaktioner, som vi vil dække i dette indlæg:
- Benzylisk bromering – fritradikal bromering af alkylgruppen ved siden af en aromatisk ring
- Benzylisk oxidation – fuldstændig oxidation af en alkylgruppe ved siden af benzen til en carboxylsyre.
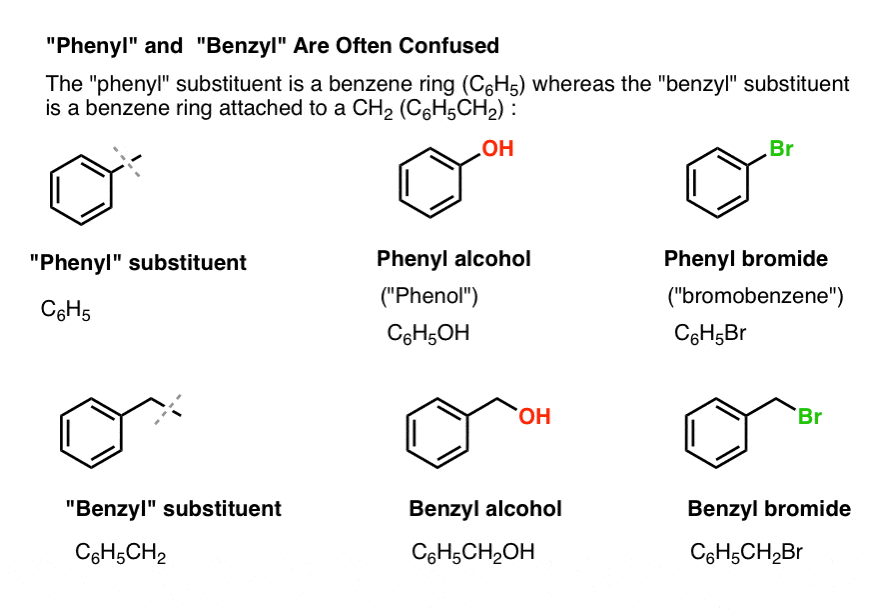
3. “Phenyl” vs. “Benzyl” : Hvad er forskellen?
Først en hurtig rækkefølge. Lad os få nogle vigtige nomenklaturer på plads, for “phenyl” og “benzyl” giver anledning til en masse forvirring:
- En phenylgruppe (eller phenylsubstituent) er benzen minus et hydrogen: C6H5 . Kulstofferne i ringen er phenylkulstofferne, og de hydrogener, der er knyttet til phenylkulstofferne, er phenyl-C-H-bindinger. Det er analogt med vinyl (se ovenfor).
- En benzylgruppe er methylbenzen minus et hydrogen: C6H5CH2 . Det kulstof, der støder op til ringen, er det benzyliske kulstof, og de hydrogener, der er knyttet til det benzyliske kulstof, kaldes benzyliske hydrogenser. Det er analogt med allyl (ovenfor).
4. Benzylradikaler er stabiliseret ved resonans; phenylradikaler er ikke.
Analogien mellem phenyl med vinyl og benzyl med allyl gælder også for stabiliteten af deres radikaler (samt deres carbocationer og anioner).
- Phenylradikaler er ikke stabiliseret ved resonans, da den orbital, der indeholder radikalet, står vinkelret på orbitalerne i pi-systemet, og der er ingen overlapning mellem dem. Radikaler på sp2-hybridiserede carbonhydrider er generelt mindre stabile end radikaler på alkylcarboner. (Se indlæg: Tre faktorer, der destabiliserer frie radikaler )
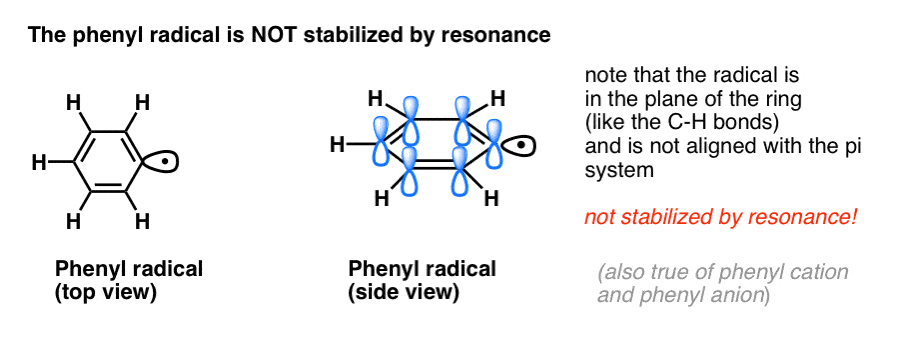
- Benzylradikaler er usædvanligt stabile, da den orbital, der indeholder radikalet, kan flugte med pi-systemet i benzenringen, ligesom i deres allyliske fætre (dette gælder også for benzylkationer og -anioner).
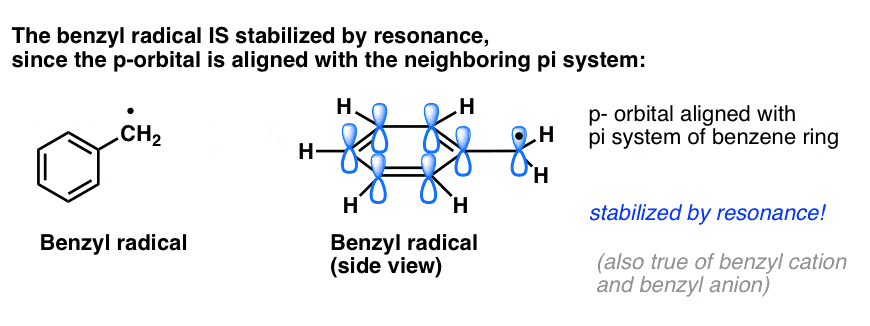
Benzyliske (og allylic) C-H-bindinger er svage, i forhold til andre alkyl-C-H-bindinger
Benzyliske C-H-bindinger har bindingsstyrker (aka BDE’er, eller bindingsdissociationsenergier) på ca. 90 kcal/mol, hvilket er betydeligt svagere end tertiære C-H-bindinger (bindingsstyrke 93 kcal/mol), sekundære C-H-bindinger (96 kcal/mol) og primære C-H-bindinger (100 kcal/mol). (Phenyl C-H-bindinger er ca. 113 kcal/mol, hvilket igen afspejler ustabiliteten af phenylradikaler).
Da bindingsdissociationsenergier afspejler hvor let det er at foretage homolytisk spaltning af C-H-bindingen (dvs. hvor let det er at dissociere bindingen i to frie radikaler) er dette en anden måde at sige, at benzylradikaler er særligt lette at danne i forhold til andre alkylradikaler.
Vi har tidligere set, at det samme gælder for allyliske C-H-bindinger . Ved “allylisk bromering” omdannes en af C-H-bindingerne på alkylgruppen, der støder op til en dobbeltbinding, til en C-Br-binding ved hjælp af N-bromosuccinimid (NBS) og lys (hν) :
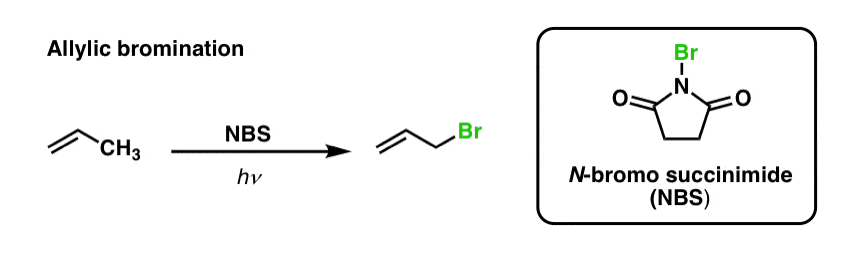
Reaktionen er selektiv for allylisk C-H i tilstedeværelse af primære, sekundære og tertiære C-H-bindinger på grund af den svagere allyliske C-H-bindingsstyrke (89 kcal/mol).
Benzylisk bromering
En lignende proces virker for “benzyliske” carbonhydrider. Vi kan bruge NBS (som ovenfor) eller blot bare Br2, da aromatiske ringe ikke er nær så reaktive med Br2 som dobbeltbindinger er det.
Når det er dannet (gennem “varme” eller “lys”, som initierer reaktionen gennem homolytisk dissociation af Br-Br), kan bromradikalet, Br- bryde de svagere benzyliske C-H-bindinger uden at røre stærkere alkyl-C-H-bindinger.
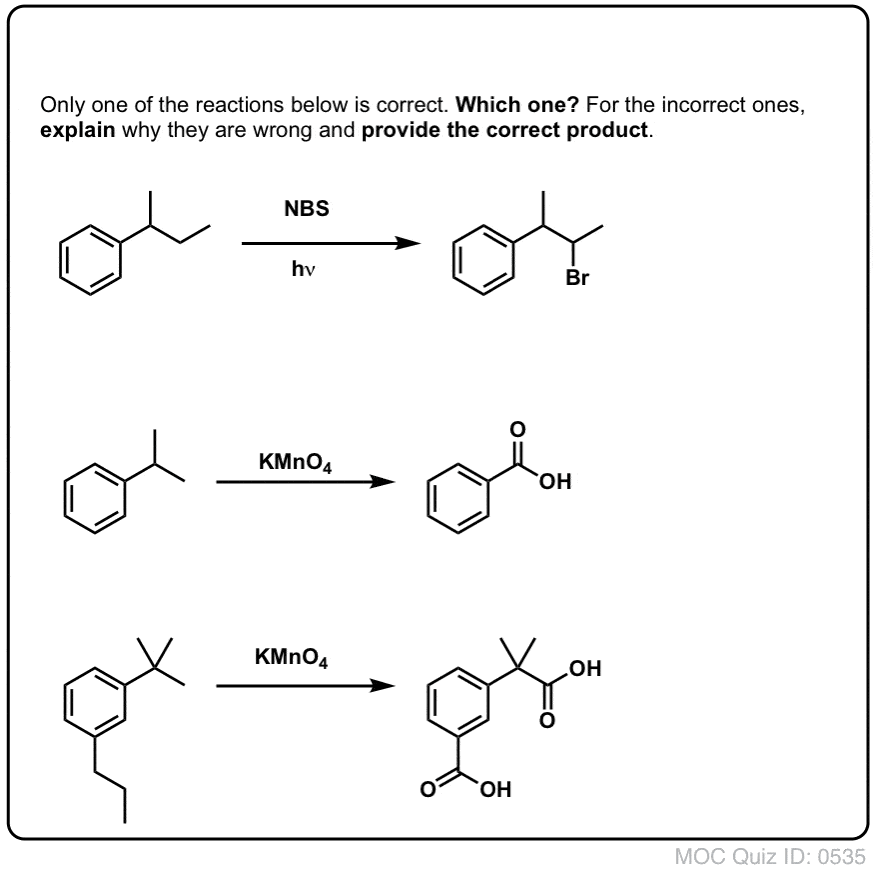
For eksempel er her produkterne af dets reaktion med toluen, og også isopropylbenzen. Bemærk, at KUN det benzyliske kulstof er bromeret. Alt andet bliver ladt i fred!
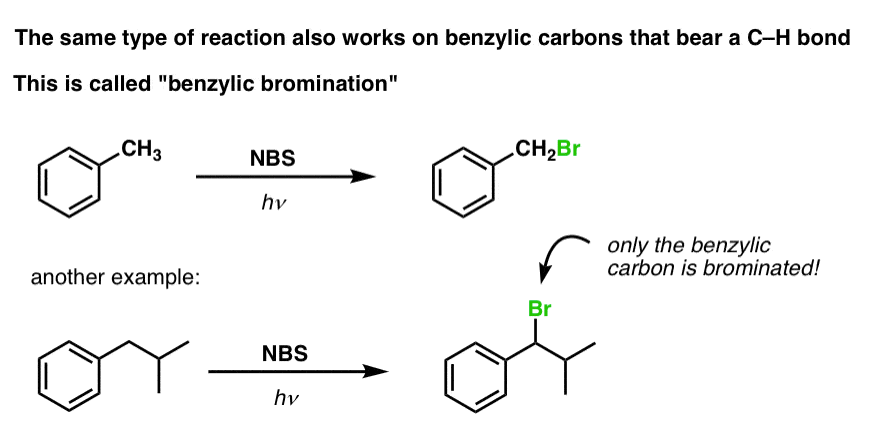
Mekanismen for benzylbromering er i det væsentlige identisk med allylisk bromering, med initierings-, udbredelses- og afslutningstrin. (Klik her for at se et pop-up billede af mekanismen.)
(For mere diskussion, se dette indlæg: Allylic Bromination )
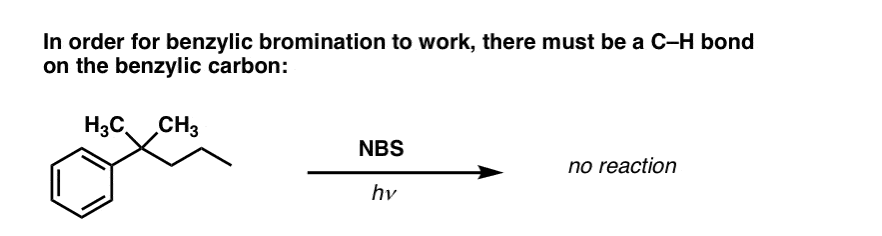
Hvornår virker “benzylisk bromination” IKKE?
Da nøglen til denne reaktion er dannelsen af det (relativt stabile) benzyliske radikal, vil benzylisk bromering mislykkes på substrater, hvor det er umuligt at generere dette radikal via brud på en C-H-binding.
Se for eksempel på eksemplet nedenfor. Hvordan kan et benzylisk radikal muligvis genereres, når benzylisk kulstof har tre alkylgrupper tilknyttet? Det kan det ikke – og reaktionen mislykkes.
Anvendelser af benzylbromering
Så hvorfor kan benzylbromering være nyttig?
Jamen, det giver os mulighed for at anvende alle de reaktioner af alkylhalogenider, som vi dækkede tilbage i Org 1 – hovedsageligt substitution og eliminering – til at fremskaffe produkter, som det ville være vanskeligt at installere direkte på en aromatisk ring gennem Friedel-Crafts-reaktioner.
For eksempel kan man bruge benzylbromering til at sætte en SN2-reaktion i gang, f.eks. efter en Friedel-Crafts alkylering:
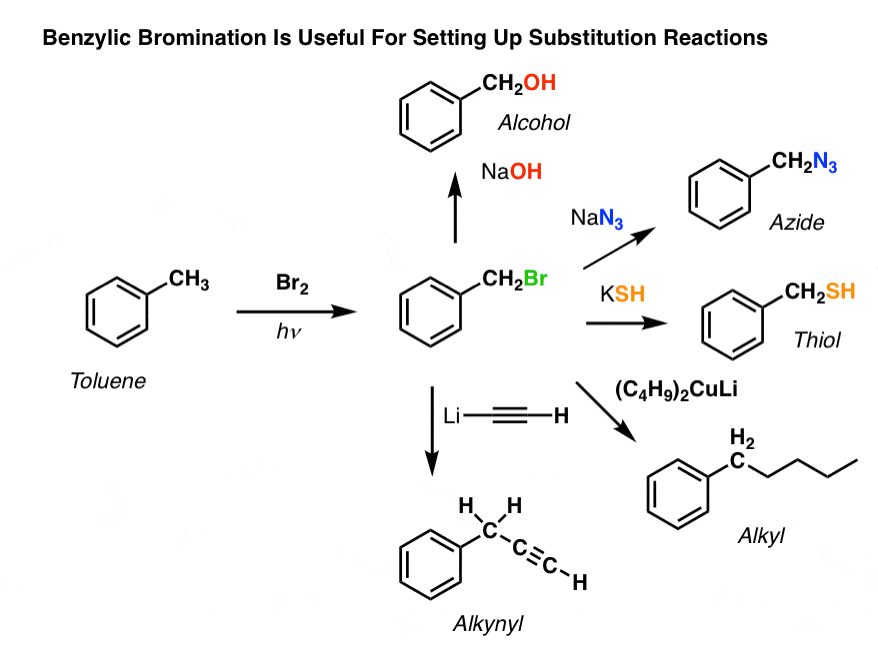
Se hvordan installation af en god afgangsgruppe på benzylpositionen giver os alle mulige muligheder for installation af forskellige funktionelle grupper?
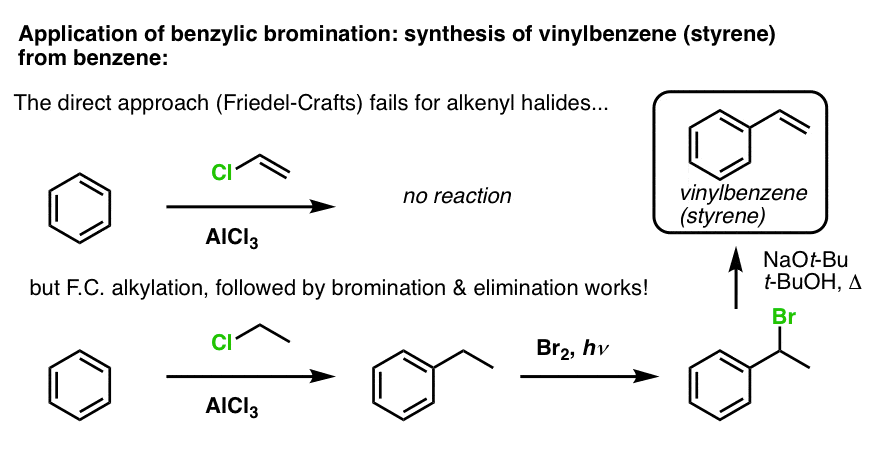
Et andet eksempel er syntesen af styren fra benzen. Ved første øjekast kan den mest direkte fremgangsmåde synes at være Friedel-Crafts-reaktionen af vinylchlorid med benzen. Men Friedel-Crafts virker ikke for alkenylhalogenider (alias vinylhalogenider)! (vinylcarbocationer er mindre stabile end alkylcarbocationer).
Vi kan komme udenom denne vejspærring ved at udføre en Friedel-Crafts alkylering med ethylchlorid, efterfulgt af benzylbromering og derefter eliminering (via E2, med noget som NaOtBu/t-BuOH) for at give alkenet:
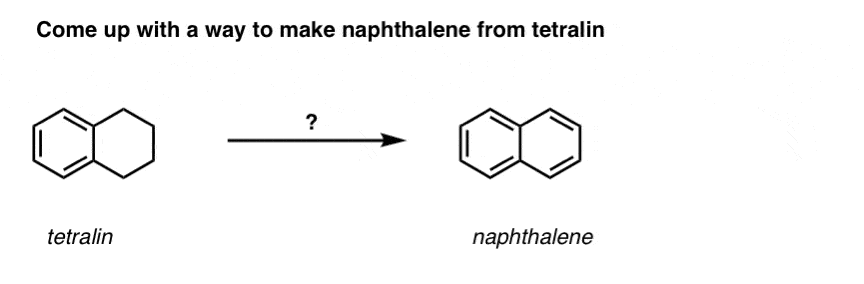
Baseret på ovenstående er her en hurtig quiz til dig. Hvordan kan du omdanne tetralin (nedenfor til venstre) til naphthalen (nedenfor til højre)? Svar i fodnoterne.
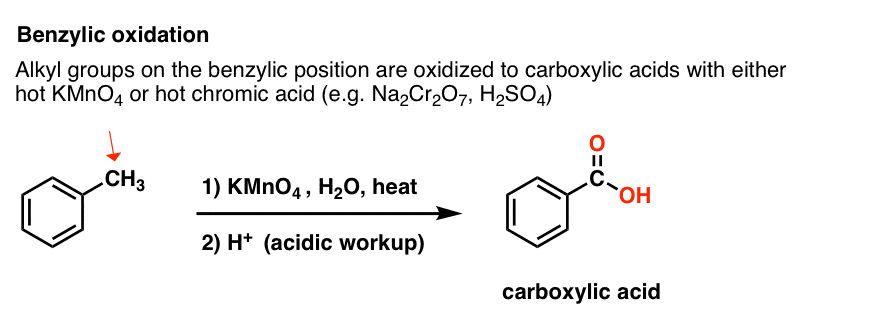
9. Benzylisk oxidation Med KMnO4 (eller H2CrO4)
Da den benzyliske C-H-binding er relativt svag, kan man med rette spørge, om andre typer reaktioner (ud over bromering) kan udføres ved denne position.
Det kan de helt sikkert! Et godt eksempel er benzylisk oxidation – hvor en benzylisk C-H-binding brydes og en benzylisk C-O-binding dannes.
Nu: Der findes ret skånsomme reagenser til benzylisk oxidation, der kemisk svarer til at kildre C-H-bindingen af med en fjer, hvilket resulterer i en benzylisk aldehyd eller keton .
Det er ikke den type benzylisk oxidation, der behandles i et typisk introduktionskursus i organisk kemi!
I stedet er det vigtigste reagens til benzylisk oxidation, der behandles i de fleste introduktionslærebøger, varm kaliumpermanganat (KMnO4). Varm chromsyre (H2CrO4, som dannes ved at kombinere et dichromatsalt som Na2Cr2O7 med en stærk syre som H2SO4) kan også bruges til disse formål.
KMnO4 er ikke subtilt. KMnO4 er ikke blid. KMnO4 er ikke venlig.
En opløsning af varmt KMnO4 er som en pose fuld af vrede piratfisk, der vil rive alt kødet af dit molekyle og kun efterlade knogler tilbage. (Når jeg tænker over det, er det lidt ligesom din lever! )
Hot KMnO4 vil bryde hver eneste benzyliske C-H-binding og omdanne den til en C-O-binding. Fra toluen er produktet f.eks. benzoesyre (en carboxylsyre).
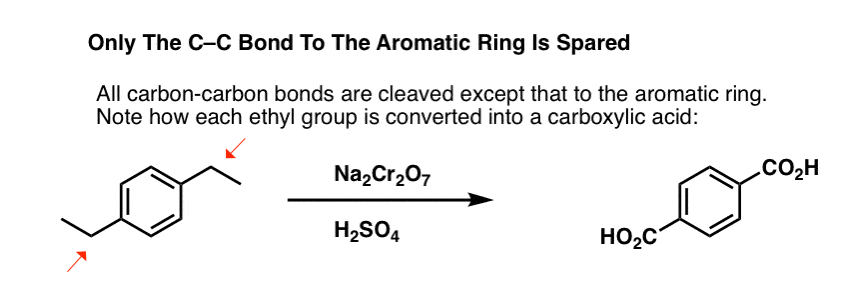
Men det bryder ikke kun de benzyliske C-H-bindinger. Åh nej. Den går også efter C-C-bindinger; i hvert fald dem, der ikke er direkte knyttet til en phenylring. For eksempel omdannes para-diethylbenzen til para-benzen-dicarboxylsyre.
Bemærk, at alkyl-C-C-bindingen skal spaltes af, for at denne oxidation kan finde sted! (den oxideres sandsynligvis hele vejen op til CO2-gas).
En interessant variation er på et cyklisk molekyle som tetralin; resultatet er dicarboxylsyren.
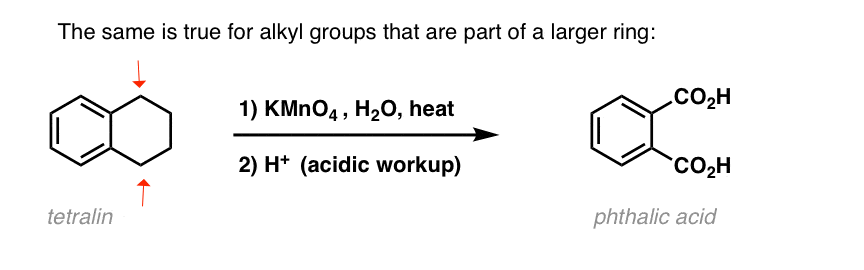
Denne dicarboxylsyre kaldes ftalsyre.
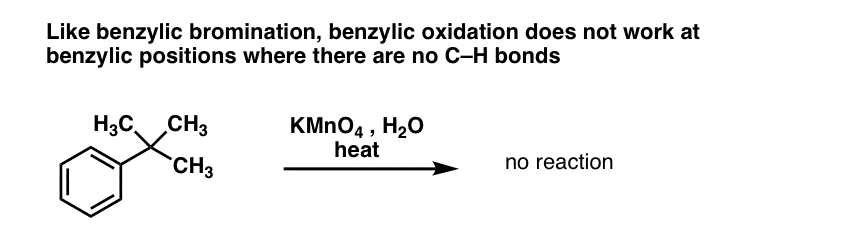
10. Benzyloxidering kræver en benzylisk C-H-binding
Som ved benzylisk bromering sker der ingen reaktion, hvis der ikke er en C-H-binding på benzylpositionen. For eksempel mislykkes reaktionen fuldstændigt med t-butylbenzen:
Den fulde mekanisme for benzylisk oxidation er for kompleks, langvarig og usikker til at vise her, men det første trin er næsten helt sikkert homolytisk spaltning af C-H-bindingen af Mn=O for at danne det benzyliske radikal.
Hvorfor er det vigtigt?
Benzylisk oxidation med KMnO4 er en barsk reaktion, men den kan have sin berettigelse. Den fungerer bedst med simple molekyler, der ikke har sarte funktionelle grupper og kan tåle en meget grov behandling.
Den første ting at bemærke er, at carboxylsyrer ikke kan placeres direkte på en benzenring via Friedel-Crafts acylering, så alkylering efterfulgt af oxidation er en nyttig omgåelse.
Den anden nyttige funktion i syntesen er det faktum, at benzylisk oxidation omdanner en o- p- director (en alkylgruppe) til en meta-director.
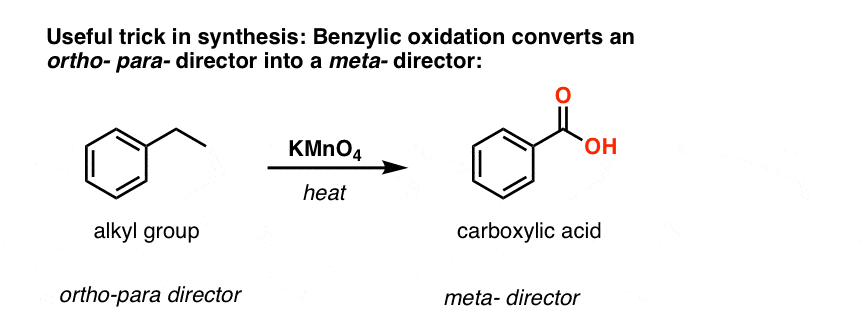
For eksempel, konfronteret med syntesen af følgende molekyle, hvordan går du så frem? (hint: det involverer en benzylisk oxidation på et eller andet tidspunkt).
Vi vil have meget mere at sige om syntese af aromatiske forbindelser i et par indlæg mere.
Næste: Reduktion af benzylkarbonyler – Clemmensen- og Wolff-Kishner-reduktionerne
Notes
“Kål” kan også bruges som slangudtryk i kemi for “alt det der på molekylet, som man af en eller anden grund roligt kan ignorere”. For eksempel er bryostatin et bæst af et molekyle, der viser sig at være lovende som kræftbekæmpelsesmiddel. Problemet er, at det kræver et ton af en sjælden bryozoan at få en anstændig mængde bryostatin, og det er ikke nok til et klinisk forsøg på mennesker. Så flere grupper har arbejdet på at fremstille enklere, lettere syntetiserbare “bryologer”, hvor de slipper af med den “kål”, der ikke er afgørende for antitumoraktiviteten.
Br2 vil generelt ikke reagere med aromatiske ringe uden en Lewis-syre-katalysator. Men hvis der er en stærk aktiverende gruppe til stede (såsom OH, NR2 osv.) kan der ske en vis bromering af ringen, især ved forhøjede temperaturer.
Sjovt faktum: “Benzylic oxidation” er svaret på gåden om, hvorfor methylbenzen (toluen) ikke er nær så potent et kræftfremkaldende stof som benzen. Det skyldes, at din lever har cytokrom p450-enzymer (som indeholder jernarter med høj oxidationstilstand), der kan oxidere den benzyliske CH3-gruppe til den mere vandopløselige carboxylsyre, så den kan blive renset ud af dine nyrer.
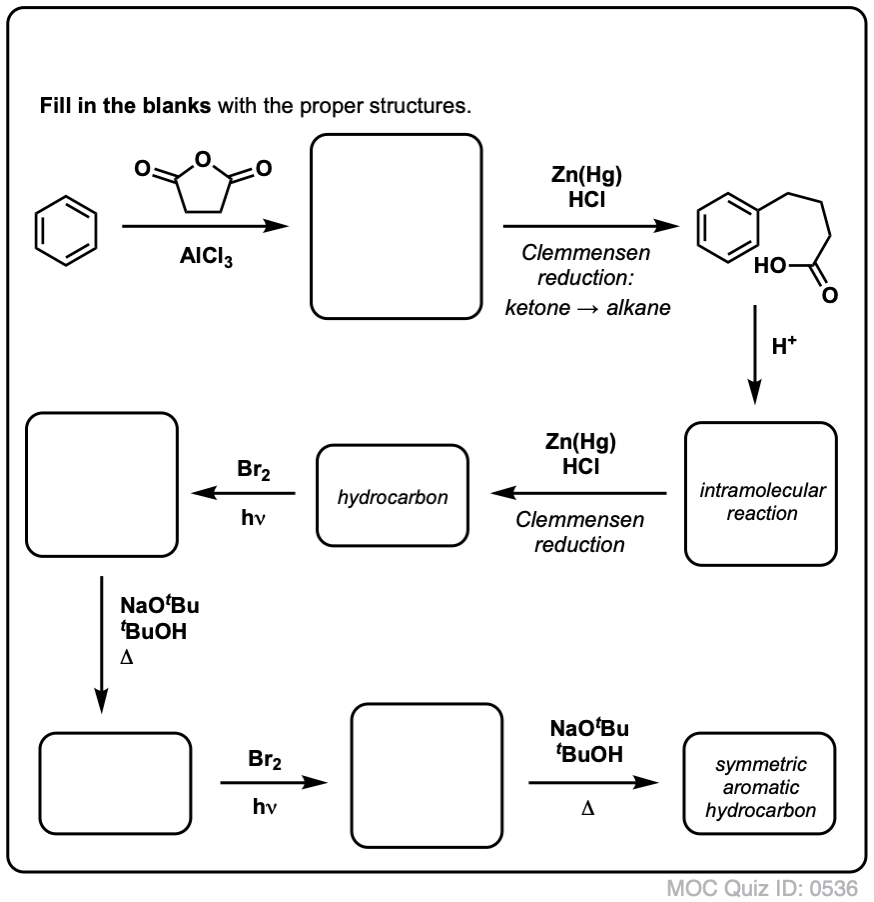
Dette kræver to oxidationer og to udskillelser. En forsigtig måde at gøre det på er at oxidere (dvs. bromere) én gang og derefter eliminere for at give et alken. Alkenet kunne derefter underkastes bromering igen (ved hjælp af NBS, så man undgår bromering af dobbeltbindingen) for at give endnu en bromering (benzylisk bromeringsprodukt vist her, men allylisk kan også lade sig gøre), som kunne behandles med base for at give aromatisk naphthalen.
(i praksis viser det sig, at begge bromeringer kan foretages på samme tid ved hjælp af Br2 ved høj temperatur. Behandling med base kan derefter give naphthalen).
Svar på quizspørgsmål 2.
Quiz dig selv!
 Klik for at vende
Klik for at vende 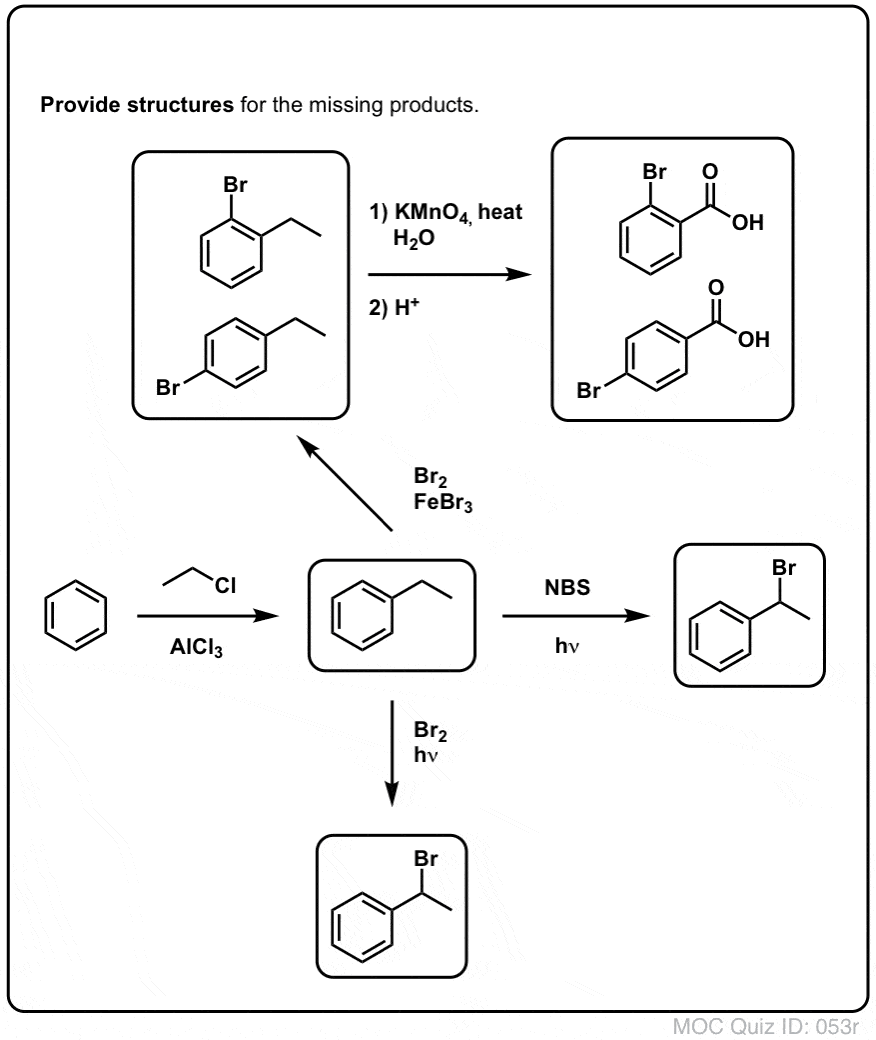
 Klik for at vende
Klik for at vende 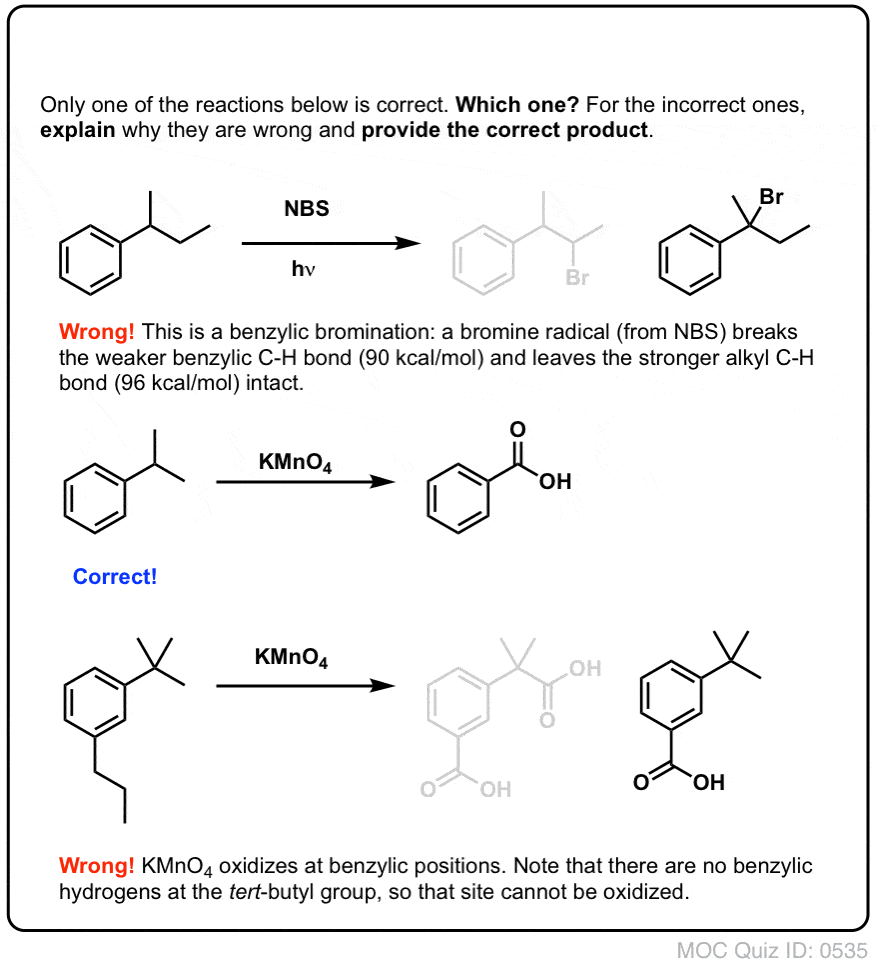
 Klik for at vende
Klik for at vende 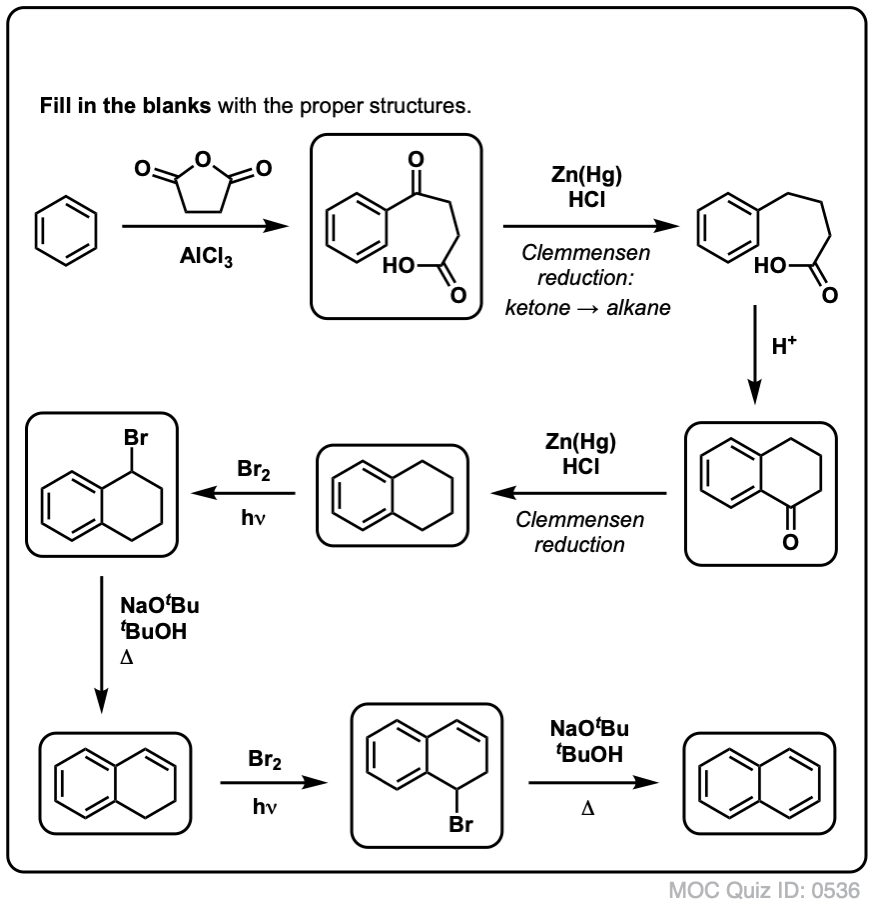
 Klik for at bladre
Klik for at bladre 
(Avanceret) Referencer og yderligere læsning
Benzylic Bromering:
Denne reaktion er også kendt som Wohl-Ziegler-reaktionen.
- Bromering ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
De to første publikationer om denne reaktion. Wohl brugte N-bromoacetamid som bromeringsmiddel, ikke NBS. Ziegler udførte derefter en detaljeret undersøgelse og rapporterede, at NBS kunne anvendes som et praktisk bromeringsmiddel til allylisk bromering. - Dibenzocyclooctene: Multi-gram syntese af en bidentatligand
Géraldine Franck, Marcel Brill og Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Benzylbromeringer med N-Bromosuccinimid i (Trifluormethyl)benzen
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Reference #3 viser en typisk benzylbromering ved hjælp af NBS i CCl4, som stort set er blevet udfaset på grund af toksicitetsproblemer. Reference #4 viser, at PhCF3 kan anvendes som opløsningsmiddel i stedet for CCl4 til benzylisk bromering. - Bromeringer med N-bromosuccinimid og beslægtede forbindelser. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
En gammel gennemgang af denne reaktion af den kendte kemiker Carl Djerassi, hvis største bidrag til den globale sundhed var udviklingen af norethindron – det første kvindelige præventionsmiddel. - N-Bromosuccinimid. III. Stereokemisk forløb af benzylisk bromering
H. J. Dauben Jr. og Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
En mekanistisk undersøgelse af stereokemien af benzylisk bromering. Ved at observere dannelsen af racemiske benzylbromider fra prochirale substrater, styrkes radikalernes intermediæritet i denne reaktion yderligere.De samme referencer fra allylisk bromering kan genbruges her: - Mekanismer for benzylbromering
Glen A. Russell, Charles. DeBoer og Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Benzylic bromination følger den samme mekanisme som allylisk bromination, som denne artikel forklarer.NBS (N-Bromosuccinimid) er et praktisk reagens til fritradikal bromering, og følgende artikler er mekanistiske undersøgelser med NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson og J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Disse artikler af professor J. C. Martin (UIUC) blev skrevet tidligt i hans karriere, før han udførte det arbejde, som han er mest kendt for (undersøgelser af “hypervalente” molekyler, herunder udviklingen af “Dess-Martin Periodinane”). - Identiteten af den kædetransporterende art i bromeringer med N-bromosuccinimid: Selektivitet af substituerede N-bromosuccinimider over for substituerede toluener
R. E. Pearson og J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimid. Mekanismer for allylbrominering og beslægtede reaktioner
J. H. Incremona og James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja0070706a034 - Succinimidylradikal som kædebærer. Mekanisme for allylbromering
J. C. Day, M. J. Lindstrom og P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radikal bromering af cyclohexen i CCl4 med bromin: Addition versus substitution
D. W. McMillen og John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Denne artikel beskriver omhyggelige kinetiske undersøgelser, der viser, at en lav koncentration af Br2 (som den, der leveres af urent NBS) vil begunstige radikal substitution frem for en polær additionsreaktion. - o-XYLYLENE DIBROMID
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
En pålidelig fremgangsmåde til benzylbromering med Br2 i Organic Syntheses. - Bromering af tetralin. Kort og effektiv syntese af 1,4-dibromonaphthalen
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek og Keith Smith
Tjekkisk. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccccc20001791
En bekvem syntese af 1,4-dibromonaphthalen fra tetralin via benzylisk bromering.Benzylisk oxidation:
Der findes mange strategier til benzylisk oxidation, herunder anvendelse af koncentrerede opløsninger af KMnO4 eller chromsyre. - Kinetiske undersøgelser af oxidation af aromatiske forbindelser med kaliumpermanganat. Del IV. n- og iso-propylbenzen
C. F. Cullis og J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDIN DERIVATIVES X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook og S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Hvis der er en anden substituent på benzylpositionen, vil oxidation give en keton i stedet for en carboxylsyre. - Heterogene permanganat-oxidationer. 7. Oxidation af alifatiske sidekæder
Nazih A. Noureldin, Dongyuan Zhao og Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenser kan adsorberes på faste bærestoffer for at gøre reaktioner lettere at gennemføre og reducere spild. I dette tilfælde ændres reaktiviteten en smule ved at gøre KMnO4-reagenset heterogent, og dette kan udnyttes til nogle kemoselektive oxidationer.En masse andre reagenser kan anvendes til benzylisk oxidation, her er et udvalg: - Selektiv oxidation ved kulstof ved siden af aromatiske systemer med IBX
K. C. Nicolaou, Phil S. Baran og Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
En tidlig artikel fra (nu rockstjerne inden for totalsyntese) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA), mens han stadig var ph.d.-studerende i Prof. Nicolaous gruppe. Her bruges IBX (et hypervalent I(V)-reagens) til at foretage benzyloxyderinger, som sker via en radikal mekanisme. Dette er en nyttig reaktion med et bredt substratområde, som eksemplificeret ved 25 eksempler i artiklen. - Direkte og selektiv benzylisk oxidation af alkylarener via C-H-abstraktion ved hjælp af alkalimetallbromider
Katsuhiko Moriyama, Misato Takemura og Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Dette bruger Oxone som terminal oxidant til benzylisk oxidation. - Syntese af benzyliske alkoholer ved C-H oxidation
Lalita Tanwar, Jonas Börgel og Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Dette bruger mesylperoxid som oxidant til selektiv oxidation af benzyliske positioner til alkoholer. Der dannes benzylmesylat, som kan hydrolyseres til alkoholen. - Elektrokemisk benzylisk oxidation af C-H-bindinger
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz og Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Benzylisk oxidation kan også udføres ved hjælp af elektrokemi. - Allyliske og benzyliske oxidationsreaktioner med natriumchlorit
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 er billigt og kan også anvendes som oxidationsmiddel.
Skriv et svar