Kombination af Ledipasvir og Sofosbuvir til behandling af infektion med Hepatitis C-virus genotype 1-infektion: Systematisk gennemgang og metaanalyse | Annals of Hepatology
On januar 20, 2022 by adminIndledning
Af de ca. 80 millioner personer i verden med kronisk hepatitis C-virus (HCV)-infektion er ca. 46 % inficeret med HCV-genotype 1, som er den mest vanskelige at behandle med interferonbaserede regimer.1 På grund af den lave behandlingssucces og de forventede bivirkninger af Pegylated-interferon (PegIFN) og Riba-virin (RBV) til behandling af HCV-inficerede patienter er der blevet gjort en indsats for at udvikle IFN-frie behandlingsregimer.2,3
Proteaseinhibitor (PI)-holdige regimer til patienter med HCV-genotype 1-infektion blev introduceret i 2011. Der har imidlertid været nogle lægemiddelinteraktioner forbundet med PI-holdige regimer, og de skal også anvendes sammen med PegIFN og havde mange bivirkninger.4 Behandlingen af patienter med HCV-genotype 1-infektion er blevet revolutioneret med indførelsen af nyere direkte virkende antivirale midler (DAA’er), herunder Sofosbuvir (SOF); en uridinnukleotidanalog hæmmer af HCV NS5B-polymerasen NS5B og Ledipasvir (LDV); en hæmmer af det HCV-kodede NS5A-protein.5,6 Den bedste behandlingsmulighed er den, der har den højeste vedvarende virologisk respons (SVR) med minimale bivirkninger i den korteste behandlingstid. Kombinationen af SOF/LDV i 12 eller 24 uger med eller uden RBV har forbedret SVR-raten på op til 95-100 % hos behandlingsnaive og IFN-erfarne patienter med HCV-genotype 1-infektion.7 Der er behov for at bestemme den nøjagtige SVR-rate for behandling med SOF/LDV i kombination med eller uden RBV i en varighed på 12 eller 24 uger. Desuden bør effekten af visse faktorer såsom cirrose, tidligere behandlingshistorie og NS5A-resistensassocierede substitutioner (RAS’er) på SVR-raten med det nævnte regime evalueres.
Der blev foretaget en metaanalyse af de aktuelt tilgængelige undersøgelser med henblik på at evaluere den antivirale effekt af SOF/LDV-kombinationsbehandling i 12 eller 24 uger med eller uden RBV hos patienter med HCV-genotype 1-infektion.
Materiale og metoderDatteressourcer og søgestrategier
I denne metaanalyse søgte vi omfattende og systematisk i elektroniske databaser, herunder PubMed, Scopus, Science Direct og Web of Science, ved hjælp af passende søgestrategier for hver database. Fokus for nøgleordene i vores søgestrategier var på behandlingsprotokoller; SOF, LDV og deres passende alternativer. For at finde eventuel eksisterende grå litteratur foretog vi desuden en søgning på Google Scholar, og efter at have fundet relaterede titler fortsatte vi vores søgning, indtil vi fandt 200 ubeslægtede titler i serier. Desuden blev der også søgt i referencerne til de fundne publikationer for at identificere eventuelle glemte publikationer i den elektroniske søgning. Vores sidste søgning blev udført den 2. september 2015, og der blev ikke taget hensyn til sproglige begrænsninger. En opdatering af vores søgning blev udført den 16. marts 2016.
Kriterier for støtteberettigelse
Alle artikler, der evaluerede effekten af kombinationsbehandling med SOF/LDV med eller uden RBV i 12 eller 24 uger på SVR, 12 uger efter afslutning af behandlingen (SVR12) blandt patienter med HCV genotype 1-infektion, blev inkluderet i denne metaanalyse. De undersøgelser med data til intention-to-treat-analyse blev inkluderet, ellers blev artiklen ekskluderet. Følgende punkter blev betragtet som vores eksklusionskriterier; patienter på hæmodialyse, patienter med tidligere historie af SOF-baseret behandling, patienter med samtidig infektion med humant immundefektvirus (HIV), patienter med dekompenseret cirrose (Child-Pugh B og C8) og historie af lever- eller nyretransplantation.
Studieudvælgelse, kvalitetsvurdering og dataudtræk
Baseret på PRISMA-retningslinjen for rapportering af systematisk gennemgang9 blev alle artikler fra søgeresultaterne gennemgået uafhængigt af to personer (MSR-Z og KH) på hvert screeningsniveau (titel, abstract og fuldtekst). Ved afslutningen af hvert screeningsniveau blev eventuelle uoverensstemmelser mellem disse to forfattere løst ved en gensidig diskussion. Uoverensstemmelser, der dog stadig var tilbage, blev løst ved konsensus og diskussion med andre kolleger (BB, SMA og HS).
Cochranes risikovurderingsværktøj til vurdering af bias blev anvendt til kvalitetsvurdering af hver enkelt inkluderet artikel10 , og følgende biasrisici blev evalueret: generering af tilfældig sekvens (udvælgelsesbias), hemmeligholdelse af allokering (udvælgelsesbias), blinding af deltager og personale (præstationsbias), blinding af resultatvurdering (detektionsbias), co-interventioner, ufuldstændige resultatdata (attrition), selektiv rapportering (rapporteringsbias), intention-to-treat-analyse, gruppelighed ved baseline, compliance, timing af resultatvurderinger og andre bias. På grundlag af denne vurdering blev hver bias-risiko for hver artikel vurderet som høj, uklar og lav. Høj og uklar risiko blev vurderet som nul og lav risiko som et. Artikler med en score på mere end 6 blev kategoriseret som studier med lav risiko. Igen blev eventuelle forskelle eller uenighed løst ved gensidig diskussion.
Følgende data for deltagere i hver arm af de inkluderede undersøgelser blev ekstraheret; køn, HCV-genotype, cirrose, polymorfismer nær IFNL3 (rs12979860), historie af tidligere behandling, behandlingsvarighed, alder, body mass index (BMI) og HCV RNA-niveau før behandling. Desuden blev der indsamlet nogle data for hver undersøgelse, herunder publikationsår, stikprøvestørrelse og landenavn.
Dataanalyse
Vidensinterval (CI) for SVR-rate i hver undersøgelse blev beregnet på grundlag af jeffreys-metoden, og gennemsnitsbeløbet af CI’s øvre og nedre grænse blev betragtet som punktestimat for SVR.11 Heterogenitetstest blev udført ved hjælp af χ2 og I-squared (intervaller fra 0 % til 100 %). P-værdi mindre end 0,1 blev betragtet som statistisk signifikant for χ2. I henhold til resultatet af heterogenitetstesten anvendte vi fixed- eller random-effect-modeller til bestemmelse af pooled SVR12 , 95 % konfidensinterval og P-værdi. Trim and fill-metoden blev anvendt til at overvinde eventuel eksisterende publikationsbias.12 STATA 10 blev anvendt til at udføre alle dele af dataanalysen.
ResultaterStudie-screening
I alt 606 artikler blev identificeret via databasesøgning. Efter fjernelse af duplikeringer var der 459 artikler tilbage til screening. Figur 1 viser antallet af artikler på hvert screeningsniveau. To andre artikler blev også fundet ved opdatering af søgning. Tyve af fuldtekstartiklerne blev vurderet med hensyn til egnethed, og endelig blev ti artikler inkluderet i vores kvantitative syntese (metaanalyse).
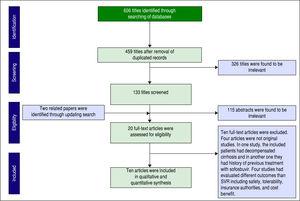
Screening af artikler baseret på PRISMA-erklæring.
Risikovurdering af bias
I betragtning af tabel 1 blev alle inkluderede undersøgelser kategoriseret som lav risiko (med at tage en score på mere end 7), og derfor blev ingen undersøgelser ekskluderet på baggrund af kvalitetsvurderingen.
Risikovurdering af bias for de inkluderede studier.
| Første forfatter (Reference) | Fremkaldt sekvensgenerering (selektionsbias) | Allokeringsafdækning (selektionsbias) | Blindning af deltager og personale (Perfomance bias) | Blinding af udfaldsbedømmelse (Detection bias) | Ufuldstændige udfaldsdata (Attrition) | Selektiv rapportering (Reporting bias) | Co-interventioner | Intention to treat-analyse | Gruppelighed ved baseline | Compliance | Tidspunkt for resultatvurderinger | Andre skævheder | Score | Score | Konklusion |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low | |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Low | |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | – | 10 | Low |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Lav |
Kendetegn ved de inkluderede undersøgelser
Baseret på målet med denne undersøgelse, viste vi karakteristika for hver arm i de inkluderede artikler i tabel 2 (kombination af SOF/LDV) og tabel 3 (kombination af SOF/ LDV/RBV).
Karakteristika for de inkluderede studier for kombination af Sofosbuvir plus Ledipasvir.
| Første forfatter (reference) | Historie om tidligere behandling | Publikationsår | Land | Land | Stikprøvestørrelse | Middelalder (SD eller interval) | Menneske køn (%) | Middel BMI (SD eller interval) | Behandlingsvarighed (uger) | Middel HCV RNA, Log IU/mL (SD) | Cirrhose (%) | rs12979860 CC/CT+TTa | HCV-genotype 1a/1bb | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0,44) | 22 (20) | 0,1 | 3,73 | ||
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0.69) | 34 (16) | 0.34 | 2.18 | ||
| Gane, E.J.13 | TE | 2014 | New Zealand | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6,5 (0,6) | 10 (100) | 0,11 | 4 | ||
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0,8) | 0 (0) | 0,35 | 3,9 | ||
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11.6) | 11 (58) | 28.1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 | ||
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6,6) | 15 (79) | 31,4 (4.7) | 12 | 6,3 (0,5) | 11 (58) | 0,11 | 18 | ||
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | op til 20 % | 0.33 | 1,22 | ||
| Mizokami, M.20 | MIX | 2015 | Japan | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6,6 (0,5) | 41 (24) | 1,011 | 0,042 | ||
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0.68) | 5 (12) | 5 | 0.10 | |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0,55) | 4 (9) | 1,26 | 0,16 | ||
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0,57) | 22 (20) | 0,17 | 3,54 | ||
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0,68) | 33 (15) | 0,31 | 2,14 | ||
| Bourliere, M.21 | TE | 2015 | Frankrig | 78 | 57 (10.7) | 56 (72) | 26.3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
Karakteristika for de inkluderede studier for kombination af sofosbuvir plus ledipasvir og ribavirin.
| Første forfatter (reference) | Historie om tidligere behandling | Publikationsår | Land | Stikprøvestørrelse | Middelalder (SD eller interval) | Menneske køn (%) | Middel BMI (SD eller interval) | Behandlingsvarighed (uger) | Middel HCV RNA, Log IU/mL (SD) | Cirrhose (%) | rs12979860 CC/CT+TT* | HCV-genotype 1a/1b** | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0,54) | 22 (20) | 0,11 | 3,82 | ||
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0.64) | 33 (15) | 0.53 | 2.55 | ||
| Gane, E.J.13 | TN | 2014 | New Zealand | 25 | 45 (9.2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 | ||
| Gane, E.J.13 | TE | 2014 | New Zealand | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 | ||
| Gane, E.J.13 | TE | 2014 | New Zealand | 9 | 57 (5,2) | 8 (89) | 27,3 (0.5) | 12 | 27.3 (0.5) | 9 (100) | 0.2 | 3.5 | ||
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9,8) | 14 (67) | 31,5 (7.3) | 12 | 6,2 (0,4) | 11 (52) | 0,05 | 3,2 | ||
| Mizokami, M.20 | MIX | 2015 | Japan | 170 | 59 (9,5) | 73 (43) | 23,3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 | ||
| Stedman, C.A.M.14 | MIX | 2015 | New Zealand | 14 | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5,6-7,5) | 1 (7) | 0,4 | 2,5 | |
| Bourliere, M.21 | TE | 2015 | Frankrig | 77 | 56 (7,4) | 58 (75) | 27,9 (5.5) | 12 | 6,5 (0,5) | 76 (98,7) | 0,05 | 1,71 | ||
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0,60) | 22 (20) | 0,19 | 3,82 | ||
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
Evaluering af behandlingsresultat
Vi beregnede poolet SVR12 for fire HCV-behandlingsregimer, herunder 12 uger med SOF/LDV (A), 24 uger med SOF/LDV (B), 12 uger med SOF/LDV/RBV (C) og 24 uger med SOF/LDV/RBV (D). Resumé af resultaterne af disse metaanalyser er vist i tabel 4.
- –
Behandlingsregime A (12 ugers sofosbuvir plus ledipasvir). Der blev fundet ti arme i otte undersøgelser, som evaluerede regimen A (tabel 2). Der var en betydelig heterogenitet mellem resultaterne af undersøgelsesarmene (χ2 = 35,01, P Figur 2A). Både Beggs test (P = 0,074) og Eggers lineære regressionstest (P
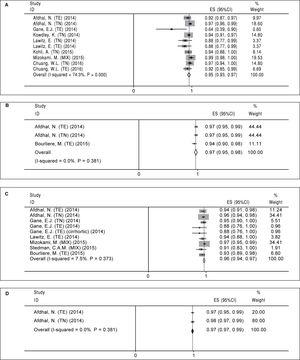 Figur 2.
Figur 2.Pooled SVR12 for Sofosbuvir plus Ledipasvir-regimen efter behandlingsvarighed og tilføjelse af Ribavirin. A. Pooled SVR12 for 12 ugers behandling med sofosbuvir plus ledipasvir. B. Sammenlagt SVR12 for 24 ugers behandling med sofosbuvir plus ledipasvir. C. Samlet SVR12 for 12 ugers behandling med sofosbuvir plus ledipasvir og ribavirin. D. SVR12 i pulje for 24 ugers behandling med sofosbuvir plus ledipasvir og ribavirin. TE: behandlingserfaring. TN: treatment naïve.
(0,39MB).- –
Behandlingsregime B (24 uger med sofosbuvir plus ledipasvir). For behandlingsregime B fandt vi kun tre arme i tre artikler (tabel 2). Der blev ikke fundet nogen signifikant heterogenitet med hensyn til relaterede undersøgelser til dette regime (χ2 = 1,92, P = 0,38, I-squared = 0 %). Baseret på en model med fast effekt var poolet SVR12 for regimen B 97 % (95 %CI = 95 %-98 %) (Figur 2B). Da antallet af de inkluderede undersøgelser var lille (n = 3), kørte vi ikke relaterede tests for publikationsbias.
- –
Behandlingsregime C (12 uger med sofosbuvir plus ledipasvir og ribavirin). Der blev fundet ni undersøgelsesarme i syv artikler for denne type behandling (tabel 3). Da der ikke blev fundet nogen signifikant heterogenitet (χ2 = 8,64, P = 0,37, I-squared = 7,5 %), blev der anvendt fixed-effect-model, og pooled SVR12 blev beregnet som 96 % (95 %CI = 94 %-97 %) (Figur 2C). Der var publikationsbias baseret på både Begg’s (P = 0,009) og Eggers lineære regressionstest (P = 0,001). Baseret på trim- og fyldmetoden blev poolet SVR12 beregnet som 96 % (95 %CI = 94 %-97 %).
- –
Behandlingsregime D (24 uger med sofosbuvir plus ledipasvir og ribavirin). Som det fremgår af tabel 3, var der to undersøgelsesarme i to artikler for dette regime. Der var ingen signifikant heterogenitet med hensyn til resultaterne af disse to undersøgelser (χ2 = 0,77, P = 0,38, I-squared = 0 %), og i henhold til fixed-effect-modellen blev pooled SVR12 beregnet som 98 % (95 %CI = 97 %-99 %) (figur 2D). På grund af det lille antal inkluderede undersøgelser (n = 2) kunne vi ikke udføre de relaterede tests for publikationsbias.
Tabel 4.Resumé af metaanalyser af den vedvarende virologiske responsrate for kombination af sofosbuvir og ledipasvir.
Regimen Ribavirin-brug Behandlingsvarighed (uger) SVR-sats (%) 95%CI (%) A Nej 12 95 93-97 B Nej 24 97 95-98 C Ja 12 96 94-97 D Ja 24 98 97-99 SVR: vedvarende virologisk respons. CI: konfidensinterval.Effekt af baselineparametre på vedvarende virologisk respons
- –
Cirrhosis. I de fleste studiearme for disse fire nævnte behandlingsregimer var alle patienterne cirrhotiske eller ikke-cirrhotiske, og derfor kunne vi ikke foretage en metaanalyse af odds ratio (OR). Vi kombinerede imidlertid data for hver arm vedrørende hvert behandlingsregime og beregnede til sidst OR for virkningen af cirrose på SVR12 ved hjælp af Peto-metoden. I betragtning af figur 3A havde cirrose kun i behandlingsregime A en signifikant effekt på SVR12 (OR = 0,21, 95 %CI = 0,07-0,66).
 Figur 3.
Figur 3.Indflydelse af cirrose og tidligere behandlingshistorie på det vedvarende virologiske respons for sofosbuvir plus ledipasvir-regimen. A. Virkning af cirrose på vedvarende virologisk respons. B. Effekten af tidligere behandlingshistorie på vedvarende virologisk respons.
(0,17MB). - –
Precedent behandlingshistorie. Vi evaluerede effekten af tidligere behandlingshistorie på SVR12. Figur 3B viser kombinerede data relateret til hvert behandlingsregime og OR’er (i henhold til Peto-metoden) relateret til effekten af tidligere behandlingshistorie. På baggrund af denne analyse havde tidligere behandlingshistorie ingen signifikant effekt på SVR12 i alle regimer.
- –
NS5A-resistensassocierede substitutioner. Data vedrørende NS5A RAS’er blev uddraget fra de inkluderede undersøgelser, der evaluerede RAS’er ved baseline. Da data om dette spørgsmål ikke var tilgængelige for evaluering af hvert enkelt regime (A, B, C og D), undersøgte vi uundgåeligt effekten af RAS’erne på hovedregimen SOF/ LDV med eller uden RBV i 12 eller 24 uger. Data fra tre artikler blev ikke medtaget i denne analyse; Gane, et al.13 på grund af tilføjelse af en anden medicin (GS-9669) til SOF/LDV-regimet i to undersøgelsesarme, Stedman, et al.14 på grund af utilgængelige data om evaluering af RAS’er på SVR og Kohli, et al.15 på grund af utilstrækkelige data om antallet af patienter med SVR og NS5A RAS’er. Desuden evaluerede Kowdley og kolleger6 effekten af SOF/LDV i 8 uger i den ene arm af deres undersøgelse, og da vi ikke kunne adskille de rapporterede data om NS5A RAS’er og SVR fra denne arm, udtog vi alle data fra denne undersøgelse og inkluderede dem i denne metaanalyse. Ifølge figur 4 havde NS5A RAS’er en signifikant reducerende effekt på SVR i SOF/LDV-regimet (OR = 0,31, 95 % CI = 0,2-0,5). Der var ingen heterogenitet på tværs af resultaterne af studierne med hensyn til påvisning af NS5A RAS’er ved baseline og behandlingsrespons. Der blev heller ikke fundet nogen publikationsbias baseret på Beggs (P = 0,65) og Eggers (P = 0,67) test.
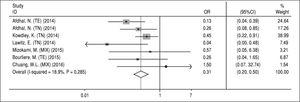 Figur 4.
Figur 4.Effekt af NS5A-resistens-associerede substitutioner på det vedvarende virologiske respons for sofosbuvir plus ledipasvir-regime.
(0,12MB).Diskussion
Den aktuelle metaanalyse viste den høje effektivitet af SOF/LDV-kombinationsbehandling hos patienter med kronisk hepatitis C genotype 1-infektion. Den tidligere standardbehandling til behandling af HCV-genotype 1-infektion var PegIFN og RBV med en SVR-rate på under 60 % hos patienter med HCV-genotype 1-infektion, og behandlingen var ledsaget af mange bivirkninger.16
Den tidligere anerkendelse af nøgleproteiner i HCV-replikationscyklusen gav mulighed for at målrette disse proteiner og hæmme produktionen af virioner.17 HCV-behandlingsregimer har haft en lang historie fra IFN-baserede til IFN-fri regimer. Dette gav et behandlingsregime med høj SVR-rate, kort behandlingsvarighed og få bivirkninger. Målet om at have en IFN-fri behandlingsregime til HCV-genotype 1-infektion blev nået med indførelsen og godkendelsen af SOF/LDV-regimet i 2014.18
SOF/LDV kan anvendes med eller uden RBV og i forskellige behandlingsvarigheder (12 eller 24 uger).7 Nogle vigtige faktorer kan tages i betragtning ved valg af passende regime, såsom eksistensen af cirrose og RBV-kontraindikation. Omkostningerne ved dette regime er imidlertid en anden væsentlig faktor for valg af behandlingsvarighed. Det er interessant, at det i den aktuelle undersøgelse er blevet vist, at SVR i alle regimer på 12 eller 24 uger med eller uden RBV var lige store og mere end 95 %, herunder 95 % for 12 ugers behandling med SOF/LDV, 97 % for 24 ugers behandling med SOF/LDV, 96 % for 12 ugers behandling med SOF/LDV/RBV og 98 % for 24 ugers behandling med SOF/LDV/RBV. Det er rigtigt, at tilføjelse af RBV til SOF/LDV eller forlængelse af SOF/LDV til 24 uger kan resultere i en lille stigning i SVR12 fra 95 % til 96 %, men i den aktuelle undersøgelse blev det imidlertid observeret, at cirrose (Child-Pugh A) kan påvirke (OR = 0,21) SVR12 blot i et regime med 12 ugers behandling med SOF/LDV. Som følge heraf anbefaler vi at behandle cirrhotiske patienter (Child-Pugh A) med SOF/LDV/RBV i 12 uger eller med SOF/LDV i 24 uger på baggrund af RBV-kontraindikationen og prisspørgsmålet, mens det ser ud til, at behandling af ikke-cirrhotiske patienter med SOF/LDV i 12 uger er acceptabel. I denne metaanalyse blev der ikke observeret nogen indvirkning af tidligere behandlingshistorie (andre end SOF-baserede regimer) på behandlingssuccesen i ingen af de fire regimer med SOF/LDV. Som følge heraf anbefales det ikke at vælge behandlingsvarighed eller at tilføje RBV til SOF/LDV-regimet på baggrund af tidligere behandling med PegIFN/RBV eller PI-holdige regimer.
I denne undersøgelse indsamlede vi data til vurdering af virkningen af baseline NS5A RAS’er på behandlingssucces, men i ingen af disse undersøgelser var dataene til resistensvurdering stratificeret med hensyn til behandlingsregime. Som følge heraf blev dataene for alle arme i hver undersøgelse inkluderet i denne metaanalyse. I denne metaanalyse blev det konstateret, at baseline-RAS’erne i NS5A-genet i HCV som parameter påvirkede behandlingsresponsraten. Det er værd at bemærke, at de fleste patienter med behandlingssvigt havde NS5A RAS’er på tidspunktet for behandlingssvigtet, hvilket viser NS5A RAS’ernes store rolle i behandlingssvigt hos patienter, der behandles med LDV6,7,19-22 . Den kliniske nytteværdi af vurdering af NS5A RAS’er før behandlingsstart er imidlertid endnu ikke defineret, måske på grund af den høje behandlingsresponsrate på SOF/LDV og den meget lave specificitet af vurderingen af NS5A RAS’er til forudsigelse af behandlingssvigt.
Indførelsen af andre DAA’er og IFN-frie regimer og deres godkendelse til behandling af patienter med HCV-genotype 1-infektion blev fortsat efter godkendelsen af SOF/LDV. I december 2014 blev kombinationen af Ombitas-vir/Paritaprevir-r/Dasabuvir (3 direkte virkende antivirale; 3D) til HCV genotype 1-infektion med mere end 95 % effektivitet godkendt.23 I januar 2016 blev kombinationsbehandlingen med Grazoprevir/Elbasvir (GZR/EBR) med ca. 95 % SVR-frekvens godkendt.24 Da SOF har renal metabolisme, kan dette antivirale middel ikke administreres ved kronisk nyresygdom (kreatininclearance 2), og 3D og GZR/EBR er alternativerne til behandling af patienter med kronisk nyresygdom og HCV-genotype 1-infektion.25,26 Desuden har andre kombinationer af DAA’er såsom SOF/Daclatasvir (27) og SOF/ Velpatasvir28 været tilgængelige som pan-genotypiske behandlingsregimer.
Sammenfattende resulterer behandlingen af HCV-genotype 1 med SOF/LDV-kombinationen i et højt (≥ 95 %) behandlingsrespons. Beslutningen om at tilføje RBV til SOF/LDV og/eller forlængelse af SOF/LDV kan træffes på baggrund af tilstedeværelsen af cirrose, kontraindikation af RBV og omkostningsspørgsmålet. Mere identifikation af HCV-inficerede personer og bedre adgang til behandling for dem kan bidrage til udryddelse af HCV.29 Det næste mål inden for HCV-behandling er udvikling af nye HCV-terapeutiske regimer uden RBV med et lovende 100 % behandlingsrespons og uden lægemiddelreaktioner.30
Anerkendelser
Autors bidrag: Bidrag fra forfattere: Undersøgelsens koncept og design: Mohammad Saeid Rezaee-Zavareh og Khashayar Hesa-mizadeh; analyse og fortolkning af data: Mohammad Saeid Rezaee-Zavareh og Khashayar Hesa-mizadeh; analyse og fortolkning af data: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki og Heidar Sharafi; udarbejdelse af manuskriptet: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki og Heidar Sharafi: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki og Heidar Sharafi; kritisk revision af manuskriptet for vigtigt intellektuelt indhold: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki og Heidar Sharafi: Bita Behnava og Seyed Moayed Alavian.
Autors erklæring om personlige interesser
Ingen erklæret.
Deklaration af finansieringsinteresser
Ingen erklæret.
Skriv et svar