Hvad er de to typer ioner, og hvordan er de forskellige
On december 28, 2021 by adminHvad er de to typer ioner, og hvordan er de forskellige

Ion:
En ion er et positivt eller negativt ladet atom (eller en gruppe af atomer). En ion dannes ved, at et atom mister eller får elektroner, så den indeholder et ulige antal elektroner og protoner.
Eksempel: Natrium-ionen Na+, magnesium-ionen Mg2+, klorid-ionen Cl- og oxid-ionen O2-.
Der findes to typer ioner :
- kationer
- anioner.

1. Kation
En positivt ladet ion er kendt som kation. En kation dannes ved, at et atom mister en eller flere elektroner.
Eksempel: Natriumatom mister 1 elektron og danner en natriumion, Na+, som er en kation :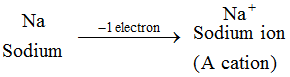 Ioner fra alle metalelementer er kationer.
Ioner fra alle metalelementer er kationer. 2. Anion
2. Anion
En negativt ladet ion kaldes en anion. En anion dannes ved, at et atom får en eller flere elektroner.
Eksempel: Et kloratom får 1 elektron for at danne en kloridion, Cl-, som er en anion.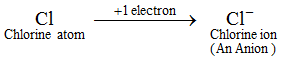 En anion indeholder flere elektroner end et normalt atom. Et normalt atom (eller et neutralt atom) indeholder lige mange protoner og elektroner. Da en anion nu dannes ved at tilføje en eller flere elektroner til et atom, indeholder en anion derfor flere elektroner end protoner. Ionerne af alle ikke-metalelementer er anioner.
En anion indeholder flere elektroner end et normalt atom. Et normalt atom (eller et neutralt atom) indeholder lige mange protoner og elektroner. Da en anion nu dannes ved at tilføje en eller flere elektroner til et atom, indeholder en anion derfor flere elektroner end protoner. Ionerne af alle ikke-metalelementer er anioner. Enkle ioner
Enkle ioner
De ioner, der er dannet af enkelte atomer, kaldes simple ioner.
Eksempel: Natriumion, Na+, er en simpel ion, fordi den er dannet af et enkelt natriumatom, Na.
Sammensatte ioner
Disse ioner, der er dannet af grupper af sammenbundne atomer, kaldes sammensatte ioner
Eksempel: En enkelt ion, Na+, er en simpel ion, fordi den er dannet af et enkelt natriumatom, Na: Ammonium-ionen NH4+, er en sammensat ion, der er dannet af to typer af sammenbundne atomer, nitrogen og hydrogen.
Ioniske forbindelser
De forbindelser, der er dannet af ioner, kaldes ioniske forbindelser. I en ionisk forbindelse holdes de positivt ladede ioner (kationer) og negativt ladede ioner (anioner) sammen af de stærke elektrostatiske tiltrækningskræfter. De kræfter, der holder ionerne sammen i en ionisk forbindelse, kaldes ioniske bindinger eller elektrovalente bindinger. Da en ionisk forbindelse består af lige mange positive ioner og negative ioner, er den samlede ladning på en ionisk forbindelse altså nul.
Eksempel: Natriumchlorid (NaCl) er en ionisk forbindelse, som består af lige mange positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
Nogle ioniske forbindelser
|
S.nr. |
Navn | Formel |
Ioner til stede |
|
1 |
Natriumchlorid | NaCl | Na+ og Cl- |
| 2 | Kaliumchlorid | KCl |
K+ og Cl- |
| Ammoniumchlorid | NH4Cl | NH4+ og Cl- | |
|
4 |
Magnesium chlorid | MgCl2 | Mg2+ og Cl- |
| 5 | Calciumchlorid | CaCl2 | Ca2+ og Cl- |
| 6 | Magnesiumoxid | MgO | Mg2+ og O2- |
| 7 | Calciumoxid | CaO | Ca2+ og O2- |
| 8 | Aluminoxid | Al2O3 | Al3+ og O2- |
| 9 | Natriumhydroxid | NaOH | Na+ og OH- |
| 10 | Kobersulfat | CuSO4 | Cu2+ og SO42- |
| 11 | Calciumnitrat | Ca(NO3)2 |
Ca2+ og NO3- |
Skriv et svar