Reakce na „benzylovém“ uhlíku: bromace a oxidace
On 12 října, 2021 by adminUhlík sousedící s aromatickým kruhem – „benzylový“ uhlík – se může účastnit několika užitečných a zajímavých reakcí. Dnes uvedeme příklady a mechanismy dvou klíčových příkladů: benzylové bromace a benzylové oxidace. Zde je stručné shrnutí:
Tabulka obsahu
- Alkylové skupiny = „hrubky“
- Něco zvláštního na alkylových skupinách přiléhajících k benzenovému kruhu
- „Fenyl“ vs „Benzyl“ : Jaký je mezi nimi rozdíl?
- Benzylové radikály jsou stabilizovány rezonancí, fenylové nikoliv.
- Benzylové (a alkylové) C-H vazby jsou slabé ve srovnání s ostatními alkylovými C-H vazbami
- Benzylové bromování
- Kdy „benzylové bromování“ NEFUNGUJE?
- Použití benzylové bromace
- Benzylová oxidace pomocí KMnO4 (nebo H2CrO4)
- Benzylová oxidace vyžaduje benzylovou C-H vazbu
- Proč je to důležité?
- Poznámky
- Testujte se!
- (pro pokročilé) Odkazy a další literatura
Alkylové skupiny = „hrubá mouka“
Ve výživě se „hrubou moukou“ nazývá veškerá celulóza a vláknina obsažená v potravinách, která jen projde vaším tělem, aniž by byla skutečně strávena.
To do značné míry popisuje chování alkylových skupin v naprosté většině reakcí organické chemie, které jsme se naučili. Jejich chemie je „nudná“. Mohou tvořit páteř a celkovou strukturu molekuly, ale jejich vazby C-H jsou ve většině reakčních podmínek inertní.
V podstatě jedinou reakcí alkylových skupin, kterou se v úvodu organické chemie zabýváme, je volná radikálová substituce, pokud nepočítáme hoření. A dokonce i tato reakce bývá dost neselektivní, zejména pokud se zabýváte chlorací volnými radikály.
Viděli jsme, že výjimku z tohoto „nudného“ chování lze nalézt u volné radikálové bromace takzvaných „alilických“ C-H vazeb . „Alylická“ poloha je uhlík, který sousedí s dvojnou vazbou (nikoli C-H na samotné dvojné vazbě! to je „vinylický“ C-H).
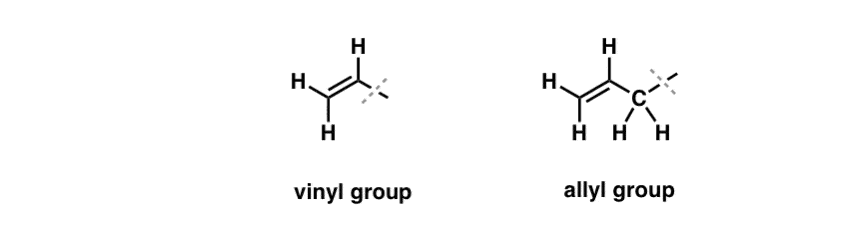
Čím je „allylická“ poloha tak zvláštní? Allylické radikály, karbokationty a anionty jsou značně stabilizované díky rezonanci. Orbital allylového radikálu, karbokationtu nebo aniontu se může sladit s p-orbitály v sousední vazbě pí, čímž vzniká větší „systém pí“ a náboj se rozloží na větší plochu.
Na alkylových skupinách přiléhajících k benzenovému kruhu je něco zvláštního
Co je důvodem tohoto malého výletu do paměti? No, nedávno jsme strávili nějakou dobu probíráním Friedelovy-Craftsovy alkylační reakce a já ve vás nechci vzbudit dojem, že umístění alkylové skupiny na benzenový kruh je syntetická slepá ulička.
Alkylové skupiny nemusí být inertní! Stejně jako alkylové uhlíky jsou alkylové skupiny, které sousedí s benzenovými kruhy, obzvláště reaktivní, což může mít nejrůznější důležité aplikace.
V tomto příspěvku se budeme zabývat dvěma důležitými reakcemi:
- Benzylovou bromací – volnoradikálová bromace alkylové skupiny přiléhající k aromatickému kruhu
- Benzylovou oxidací – úplná oxidace alkylové skupiny přiléhající k benzenu na karboxylovou kyselinu.
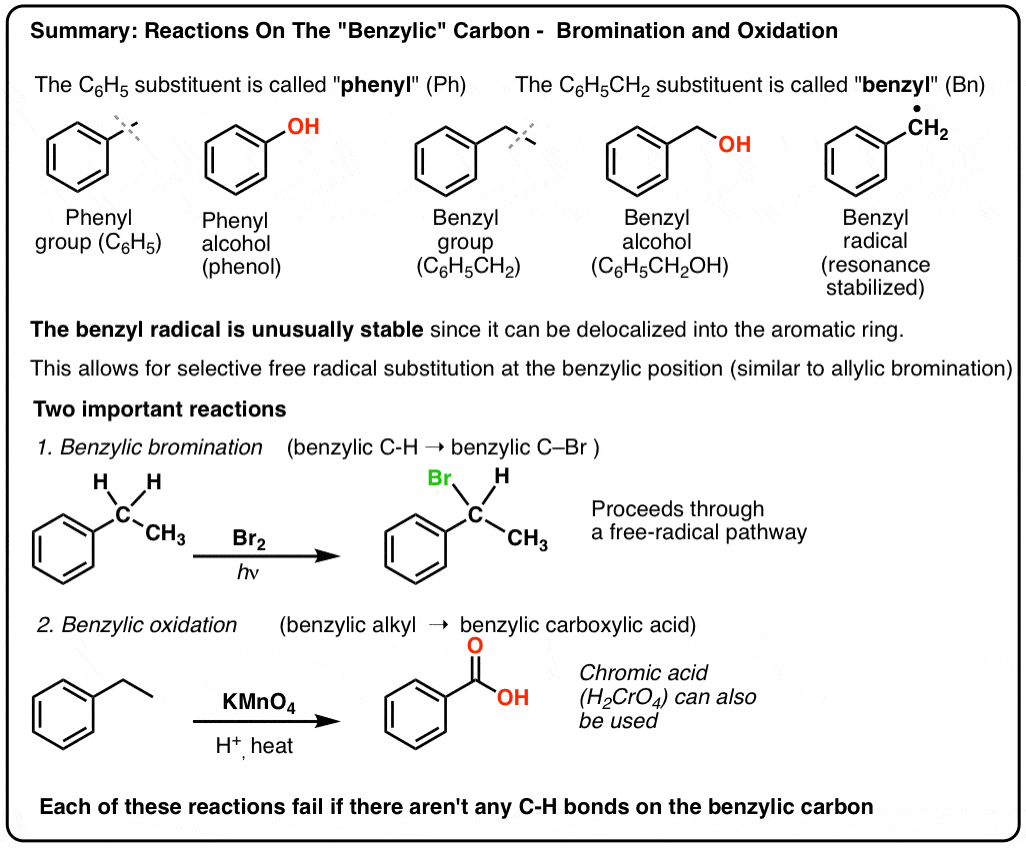
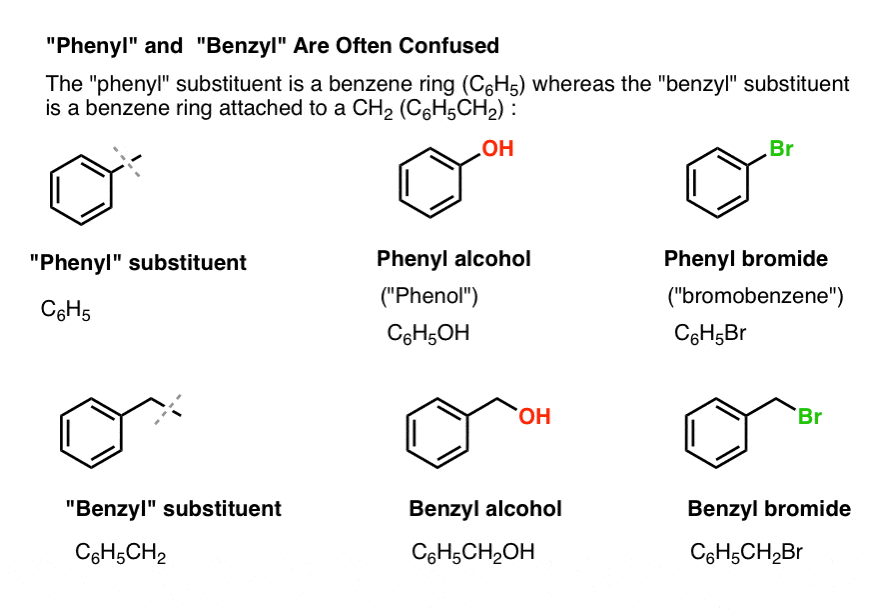
3. „Fenyl“ vs „Benzyl“ : Jaký je mezi nimi rozdíl?
Nejprve jeden rychlý postup. Ujasněme si důležité názvosloví, protože „fenyl“ a „benzyl“ způsobují mnoho nejasností:
- Fenylová skupina (nebo fenylový substituent) je benzen minus vodík: C6H5 . Uhlíky v kruhu jsou fenylové uhlíky a vodíky připojené k fenylovým uhlíkům jsou fenylové C-H vazby. Je to obdoba vinylu (viz výše).
- Benzylová skupina je methylbenzen minus vodík: C6H5CH2 . Uhlík sousedící s kruhem je benzylový uhlík a vodíky připojené k benzylovému uhlíku se nazývají benzylové vodíky. Je to analogie allylu (výše).
4. Benzylové radikály jsou stabilizovány rezonancí; fenylové radikály nikoli.
Analogie fenylu s vinylem a benzylu s allylem se vztahuje i na stabilitu jejich radikálů (a také jejich karbokationtů a aniontů).
- Fenylové radikály nejsou stabilizovány rezonancí, protože orbital obsahující radikál svírá pravý úhel s orbitaly pi-systému a nedochází mezi nimi k překryvu. Radikály na sp2 hybridizovaných uhlících jsou obecně méně stabilní než radikály na alkylových uhlících. (Viz příspěvek: Tři faktory, které destabilizují volné radikály )
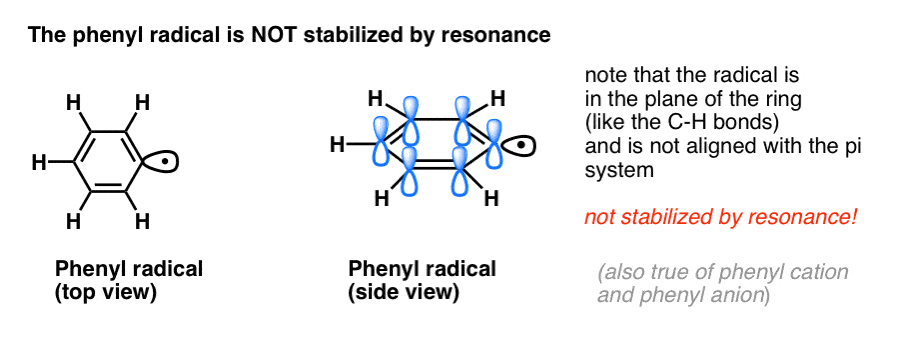
- Benzylové radikály jsou neobyčejně stabilní, protože orbital obsahující radikál se může vyrovnat s pi-systémem benzenového kruhu, stejně jako u jejich allylových příbuzných (to platí i pro benzylové kationty a anionty).
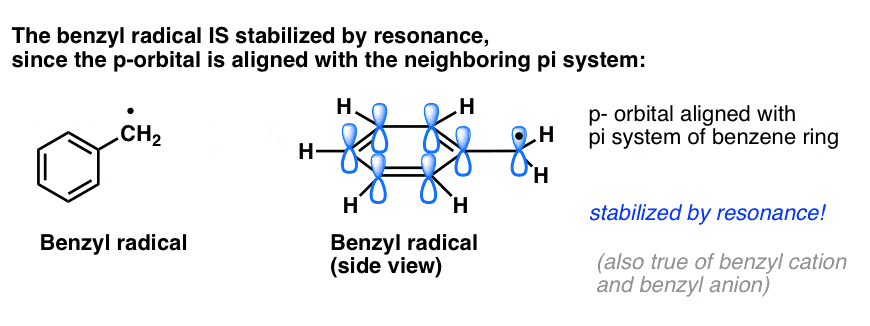
Benzylové (a allylové) C-H vazby jsou slabé ve srovnání s ostatními alkylovými C-H vazbami
Benzylové C-H vazby mají vazebné síly (tzv, nebo vazebné disociační energie) přibližně 90 kcal/mol, což je podstatně slabší než terciární vazby C-H (pevnost vazby 93 kcal/mol), sekundární vazby C-H (96 kcal/mol) a primární vazby C-H (100 kcal/mol). (Fenylové vazby C-H mají sílu asi 113 kcal/mol, což opět odráží nestabilitu fenylových radikálů ).
Protože energie disociace vazby odrážejí snadnost homolytického štěpení vazby C-H (tj. jak snadné je disociovat vazbu na dva volné radikály), je to další způsob, jak říci, že benzylové radikály se tvoří obzvláště snadno ve srovnání s ostatními alkylovými radikály.
Předtím jsme viděli, že totéž platí pro alkylové vazby C-H . Při „allylické bromování“ se jedna z vazeb C-H na alkylové skupině sousedící s dvojnou vazbou převede na vazbu C-Br za použití N-bromosukcinimidu (NBS) a světla (hν) :
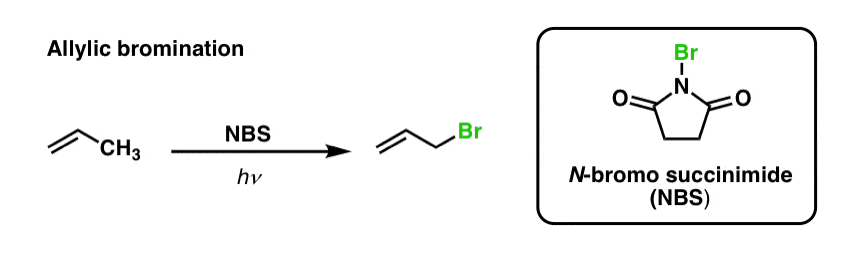
Reakce je selektivní pro allylické C-H v přítomnosti primárních, sekundárních a terciárních vazeb C-H v důsledku slabší pevnosti allylické vazby C-H (89 kcal/mol).
Benzylická bromace
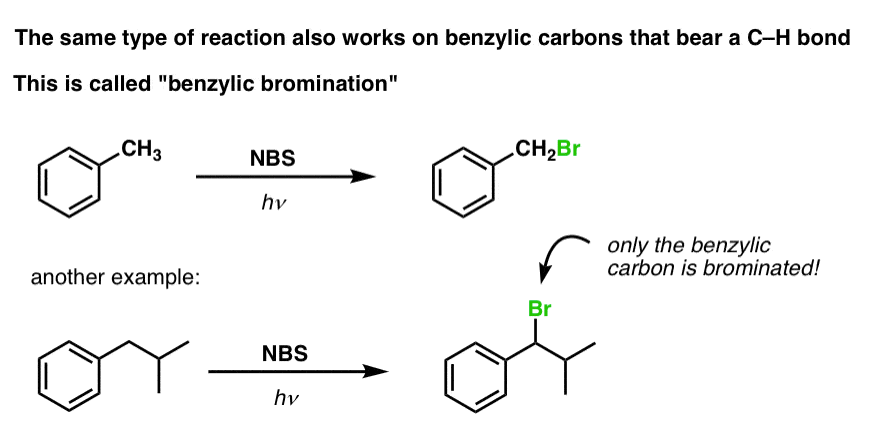
Podobný proces funguje pro „benzylické“ uhlíky. Můžeme použít NBS (jako výše) nebo prostě jen Br2, protože aromatické kruhy nejsou s Br2 zdaleka tak reaktivní jako dvojné vazby.
Po vytvoření (pomocí „tepla“ nebo „světla“, které iniciuje reakci homolytickou disociací Br-Br) může bromový radikál Br- rozbít slabší benzylové vazby C-H, aniž by se dotkl silnějších alkylových vazeb C-H.
Například zde jsou produkty jeho reakce s toluenem a také isopropylbenzenem. Všimněte si, že bromován je POUZE benzylový uhlík. Vše ostatní zůstává v klidu!
Mechanismus benzylové bromace je v podstatě totožný s mechanismem allylové bromace, s iniciačním, propagačním a terminačním krokem. (Kliknutím sem zobrazíte vyskakovací obrázek mechanismu.)
(Další diskusi naleznete v tomto příspěvku: Allylická bromace )
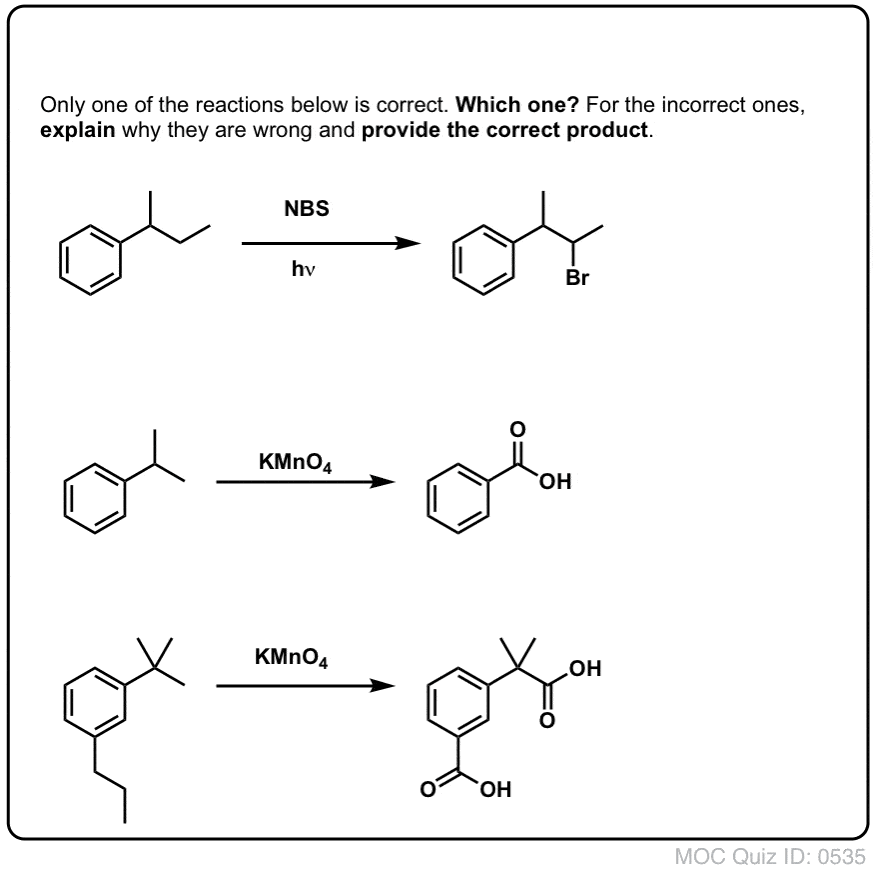
Kdy „benzylická bromace“ NEfunguje?
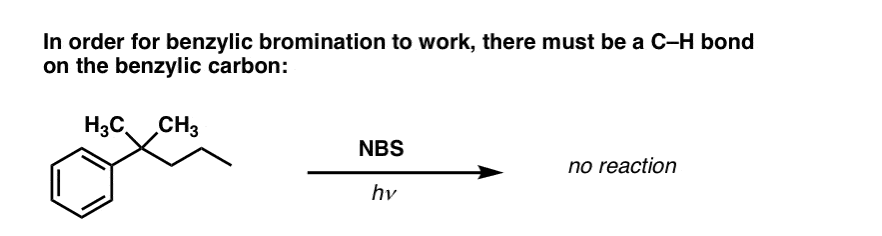
Protože klíčem k této reakci je tvorba (relativně stabilního) benzylového radikálu, benzylová bromace selže na substrátech, kde je generování tohoto radikálu prostřednictvím přerušení vazby C-H nemožné.
Podívejte se například na následující příklad. Jak je možné generovat benzylový radikál, když jsou na benzylový uhlík navázány tři alkylové skupiny? Nemůže – a reakce selže.
Použití benzylové bromace
K čemu tedy může být benzylová bromace užitečná?
No, umožňuje nám využít všechny reakce alkylhalogenidů, které jsme probrali v Org 1 – většinou substituci a eliminaci – k získání produktů, které by bylo obtížné instalovat přímo na aromatický kruh pomocí Friedel-Craftsových reakcí.
Můžeme například použít benzylovou bromaci k nastavení SN2 reakce, např. po Friedelově-Craftsově alkylaci:
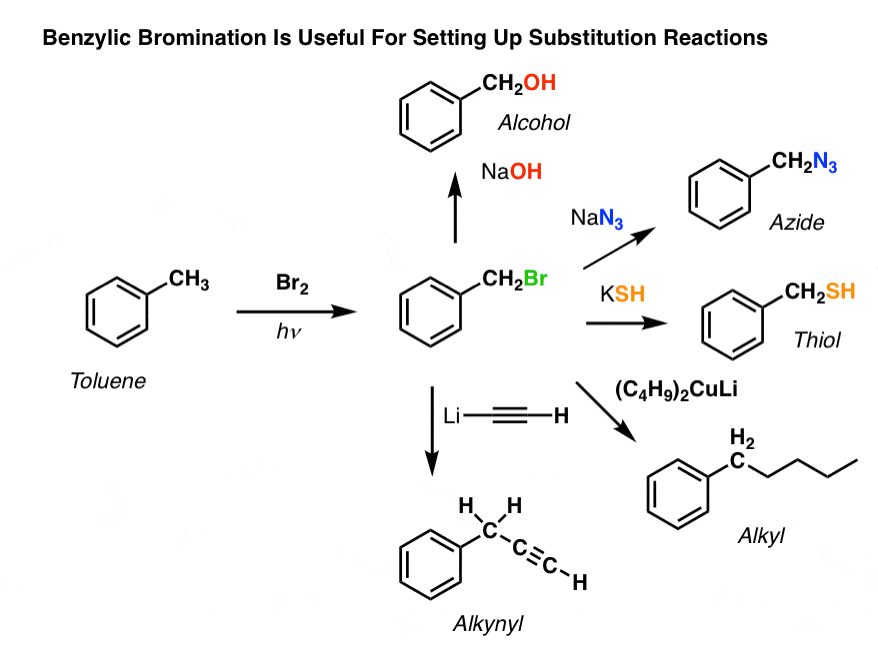
Vidíte, jak nám instalace dobré odcházející skupiny v benzylové poloze dává nejrůznější možnosti pro instalaci různých funkčních skupin?
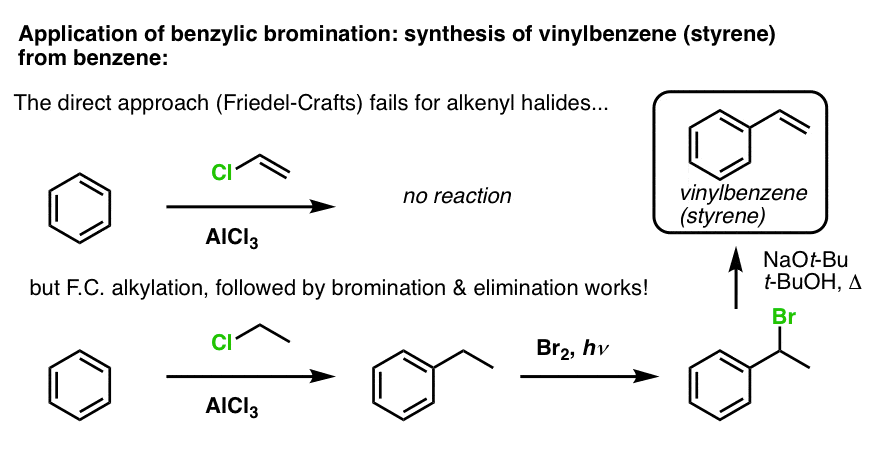
Dalším příkladem je syntéza styrenu z benzenu. Na první pohled by se mohlo zdát, že nejpřímějším postupem je Friedelova-Craftsova reakce vinylchloridu s benzenem. Ale Friedelova-Craftsova reakce nefunguje pro alkenylové halogenidy (alias vinylhalogenidy)! (vinylkarboxy jsou méně stabilní než alkylkarboxy).
Tuto překážku můžeme obejít provedením Friedelovy-Craftsovy alkylace s ethylchloridem, následované benzylovou bromací a poté eliminací (přes E2, něčím jako NaOtBu/t-BuOH), čímž získáme alken:
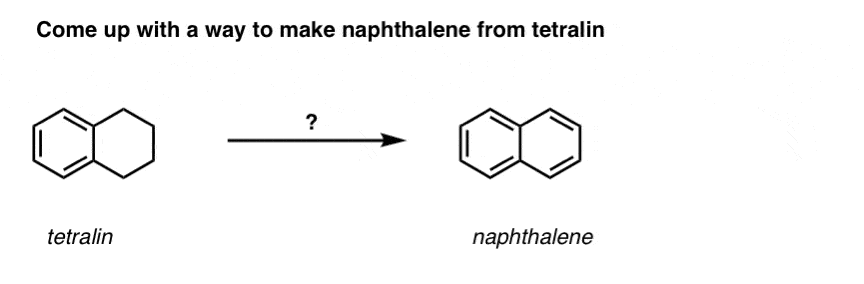
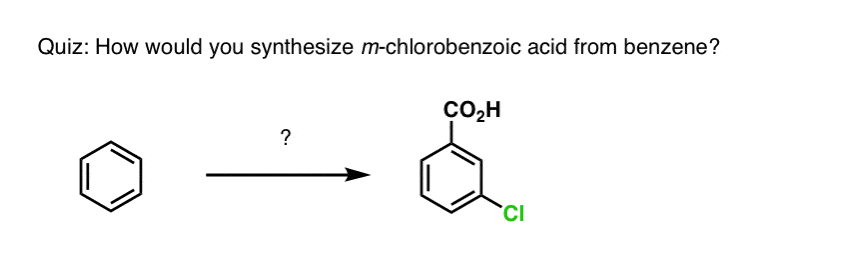
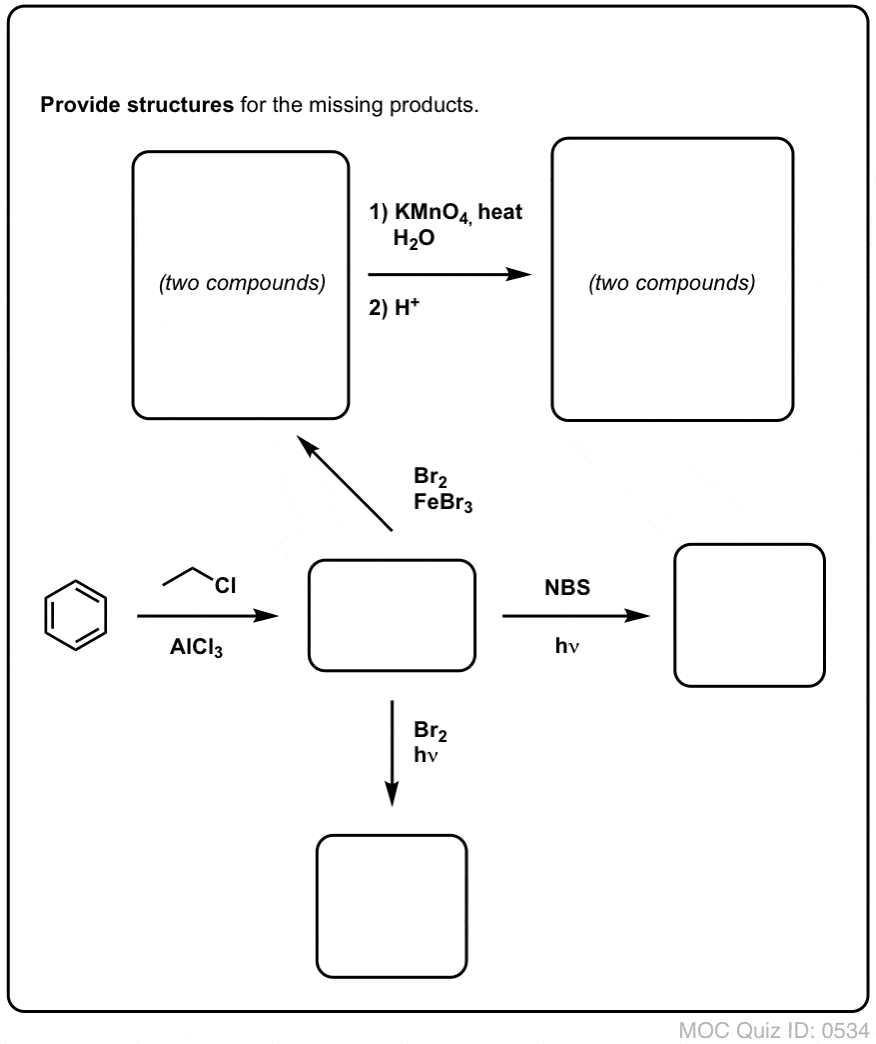
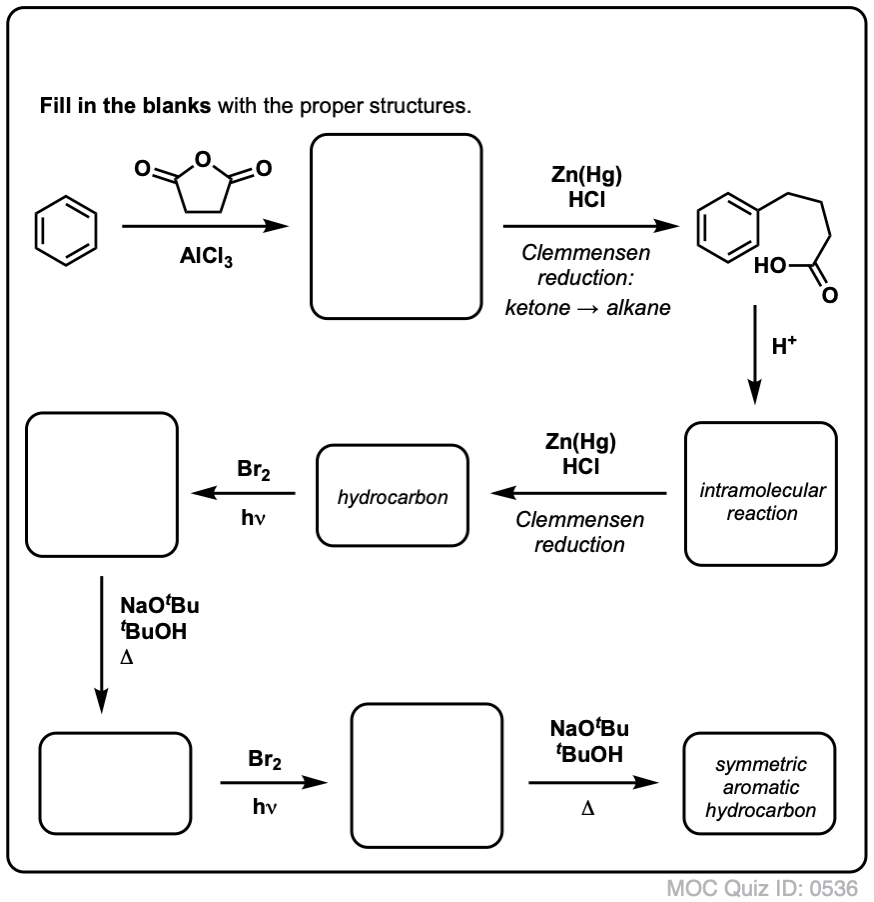
Na základě výše uvedeného vám přinášíme krátký kvíz. Jak byste mohli převést tetralin (vlevo dole) na naftalen (vpravo dole)? Odpovězte v poznámkách pod čarou.
9. Co je to tetralen? Benzylová oxidace Pomocí KMnO4 (nebo H2CrO4)
Protože benzylová vazba C-H je poměrně slabá, můžete se právem ptát, zda lze v této poloze provádět i jiné typy reakcí (kromě bromování).
Jistě lze! Ukázkovým příkladem je benzylová oxidace – při níž se přeruší benzylová vazba C-H a vznikne benzylová vazba C-O.
No a teď: existují poměrně šetrná činidla pro benzylovou oxidaci, která jsou chemickým ekvivalentem polechtání vazby C-H pírkem, jehož výsledkem je benzylový aldehyd nebo keton .
To není typ benzylové oxidace, který se probírá v typickém úvodním kurzu organické chemie!
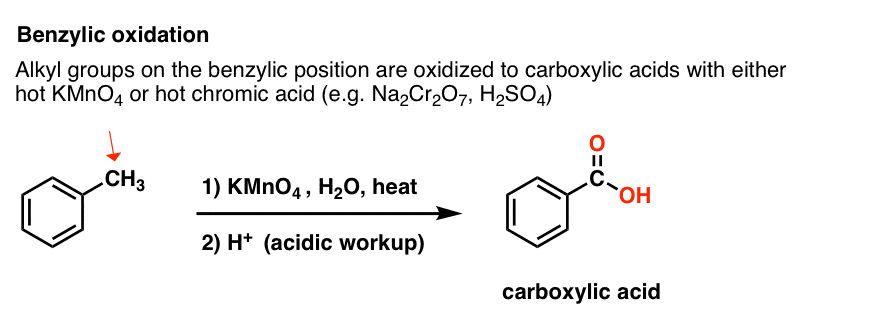
Naopak hlavním činidlem pro benzylovou oxidaci, které se probírá ve většině úvodních učebnic, je horký manganistan draselný (KMnO4). Pro tyto účely lze také použít horkou kyselinu chromovou (H2CrO4, která vzniká spojením dichromanové soli, jako je Na2Cr2O7, se silnou kyselinou, jako je H2SO4).
KMnO4 není subtilní. KMnO4 není jemný. KMnO4 není laskavý.
Roztok horkého KMnO4 je jako pytel plný rozzuřených piraní, které z vaší molekuly vyrvou všechno maso a nechají za sebou jen kosti. (Když o tom tak přemýšlím, je to něco jako vaše játra! )
Horký KMnO4 rozbije každou benzylovou C-H vazbu a přemění ji na C-O vazbu. Například z toluenu je produktem kyselina benzoová (karboxylová kyselina).
Ale nerozbíjí jen benzylové C-H vazby. Ale ne. Jde i po vazbách C-C; alespoň po těch, které nejsou přímo připojeny k fenylovému kruhu. Například para-diethylbenzen se přeměňuje na kyselinu para-benzen-dikarboxylovou.
Všimněte si, že aby k této oxidaci došlo, musí být alkylová vazba C-C odštěpena! (pravděpodobně se oxiduje až na plynný CO2).
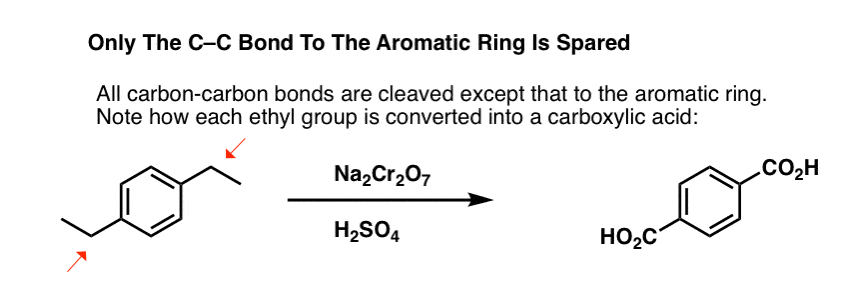
Zajímavá je varianta na cyklické molekule, jako je tetralin; výsledkem je kyselina dikarboxylová.
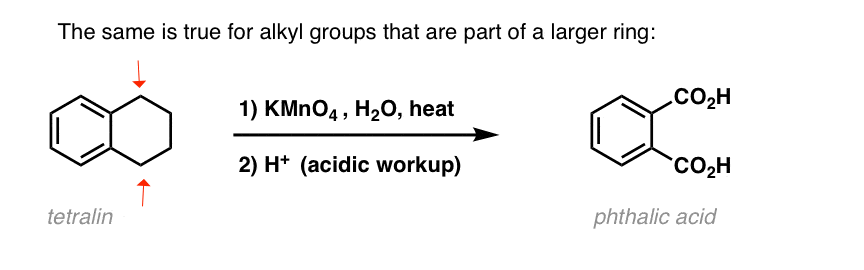
Tato kyselina dikarboxylová se nazývá kyselina ftalová.
10. Kyselina ftalová se nazývá kyselina ftalová. Oxidace benzylových kyselin vyžaduje benzylovou vazbu C-H
Stejně jako u bromování benzylových kyselin nedochází k žádné reakci, pokud na benzylové pozici není vazba C-H . Například u t-butylbenzenu reakce zcela selhává:
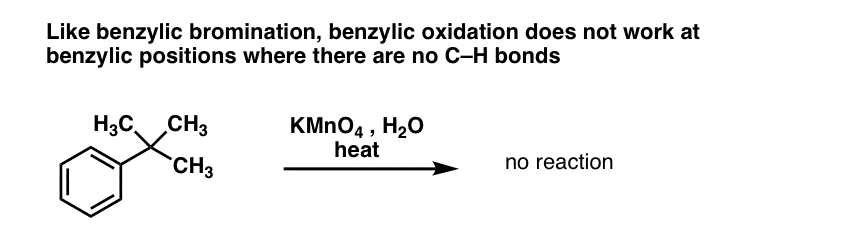
Úplný mechanismus benzylové oxidace je příliš složitý, zdlouhavý a nejistý, než abychom jej zde mohli ukázat, ale prvním krokem je téměř jistě homolytické štěpení vazby C-H pomocí Mn=O za vzniku benzylového radikálu.
Proč je to důležité?
Oxidace benzylu pomocí KMnO4 je drsná reakce, ale může mít své využití. Nejlépe funguje u jednoduchých molekul, které nemají choulostivé funkční skupiny a vydrží velmi drsné zacházení.
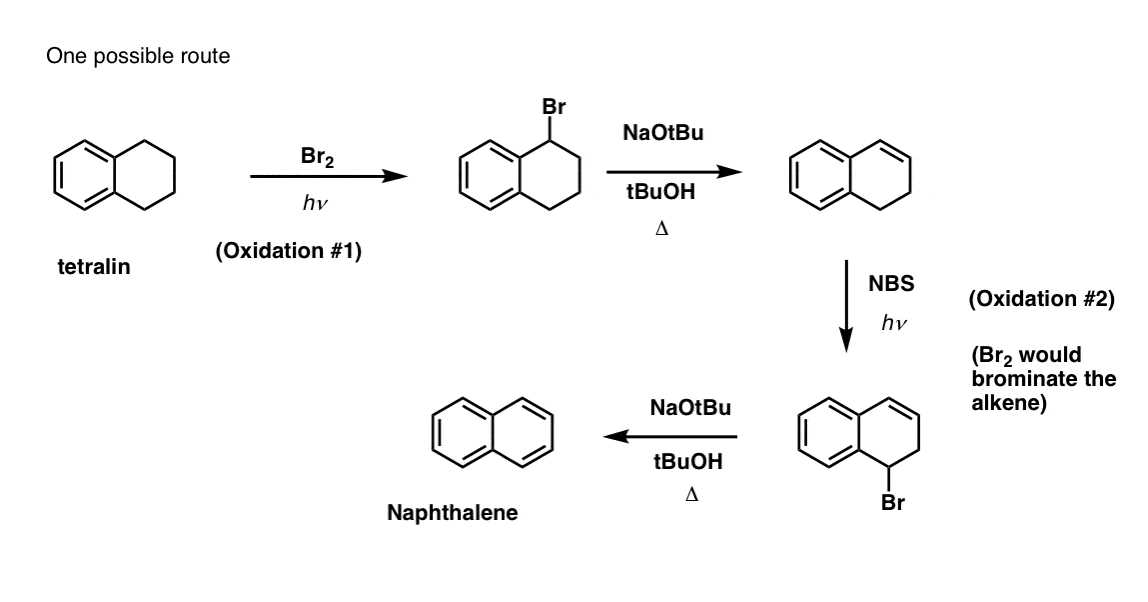
V první řadě je třeba si uvědomit, že karboxylové kyseliny nelze umístit přímo na benzenový kruh pomocí Friedelovy-Craftsovy acylace, takže alkylace následovaná oxidací je užitečným řešením.
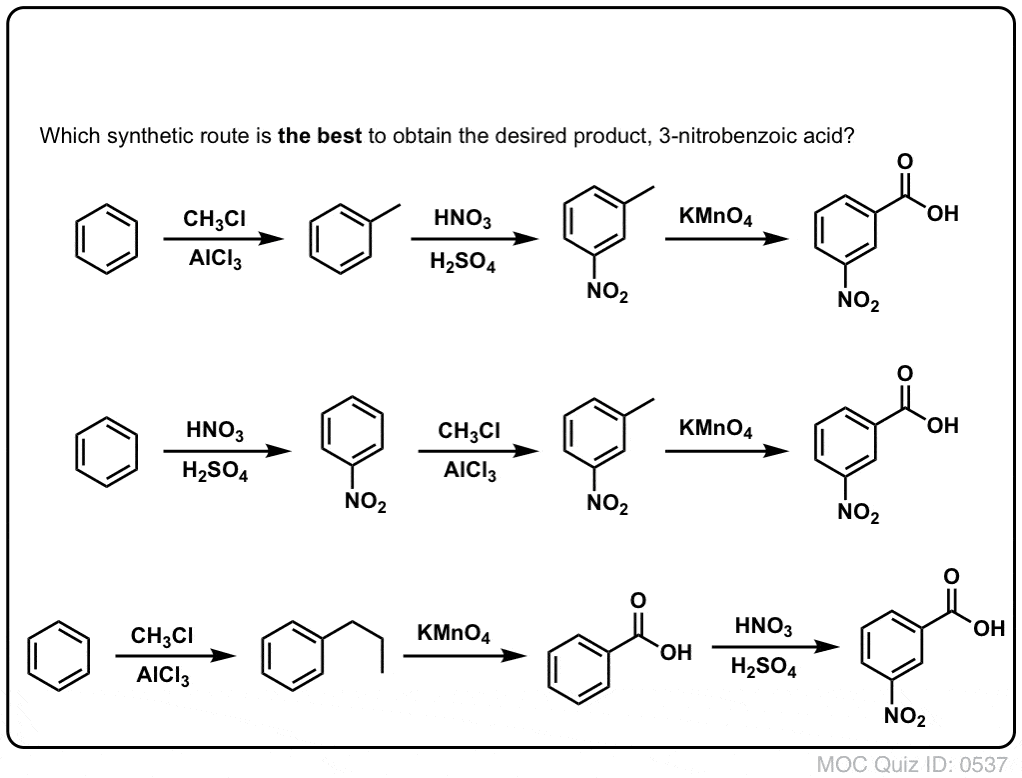
Druhou užitečnou funkcí při syntéze je skutečnost, že benzylová oxidace přeměňuje o- p- direktor (alkylovou skupinu) na meta- direktor.
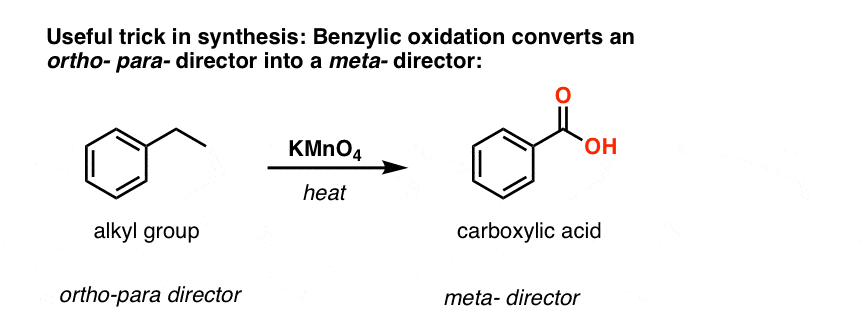
Jak například budete konfrontováni se syntézou následující molekuly? (Nápověda: v určitém okamžiku zahrnuje oxidaci benzylu).
O syntéze aromatických sloučenin si toho ještě hodně povíme v několika dalších příspěvcích.
Příště: Redukce benzylových karbonylů – Clemmensenova a Wolff-Kishnerova redukce
Poznámky
„Zelí“ se může v chemii používat také jako slangový výraz pro „všechny ty věci na molekule, které můžete z nějakého důvodu bezpečně ignorovat“. Například bryostatin je bestie na molekule, která se ukazuje jako slibná protinádorová látka. Problém je, že k získání slušného množství bryostatinu je zapotřebí tuny vzácného mechorostu, a to nestačí pro klinickou studii na lidech. Proto několik skupin pracuje na výrobě jednodušších, snáze syntetizovatelných „bryologů“, kde se zbavují „zelí“, které není pro protinádorovou aktivitu nezbytné.
Br2 obecně nereaguje s aromatickými kruhy bez katalyzátoru Lewisovy kyseliny. Pokud je však přítomna silná aktivační skupina (např. OH, NR2 atd.), může dojít k určité bromaci kruhu, zejména při zvýšených teplotách.
Zábavný fakt: „Benzylová oxidace“ je odpovědí na hádanku, proč methylbenzen (toluen) není zdaleka tak silný karcinogen jako benzen. Je to proto, že vaše játra mají enzymy cytochromu p450 (obsahující železo s vysokým oxidačním stavem), které mohou oxidovat benzylovou skupinu CH3 na ve vodě rozpustnější karboxylovou kyselinu, což umožňuje její odstranění ledvinami.
To vyžaduje dvě oxidace a dvě eliminace. Opatrný způsob, jak to provést, je jednou oxidovat (tj. bromovat) a pak eliminovat, aby vznikl alken. Alken by se pak mohl znovu podrobit bromování (za použití NBS, aby se zabránilo bromování dvojné vazby), čímž se získá další bromování (zde je uveden benzylový produkt bromování, ale allylový je také proveditelný), které by se mohlo zpracovat s bází za vzniku aromatického naftalenu.
(v praxi se ukazuje, že obě bromování lze provést najednou za použití Br2 při vysoké teplotě. Úpravou bází pak lze získat naftalen).
Odpověď na kvízovou otázku č. 2.
Kvalifikujte se!
 Klikněte pro převrácení
Klikněte pro převrácení 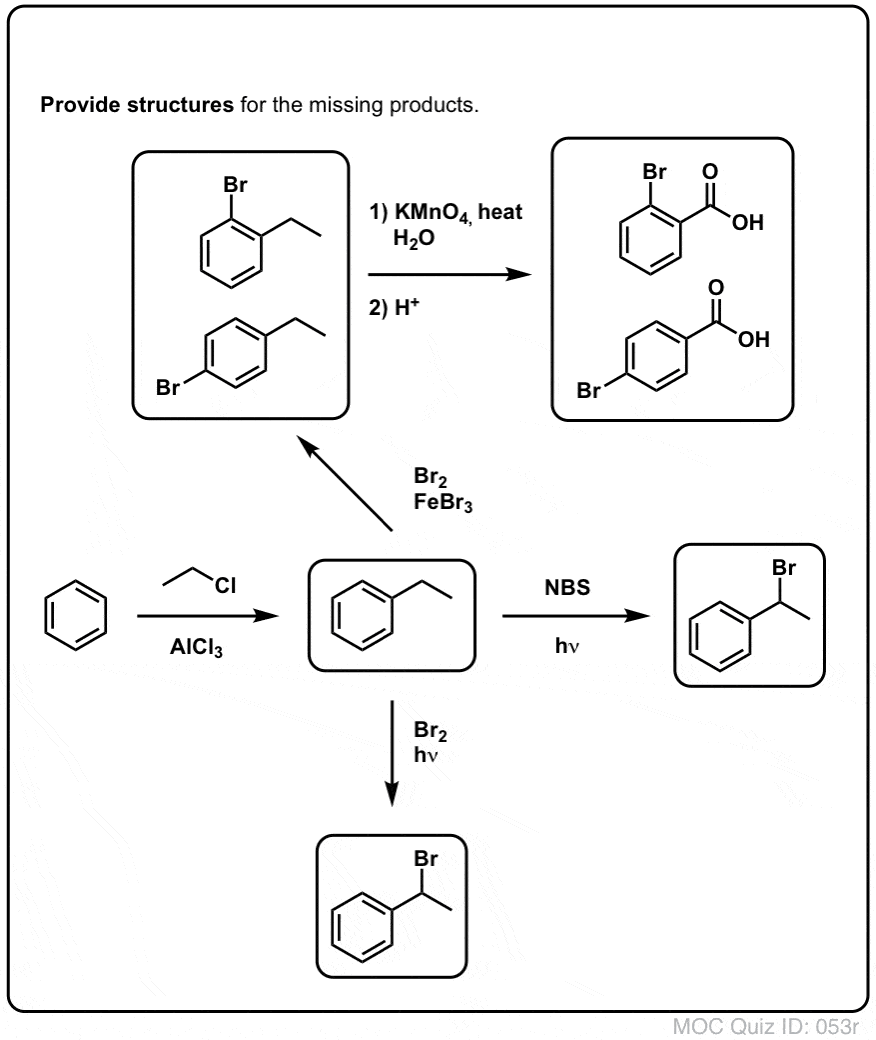
 Klikněte pro překlopení
Klikněte pro překlopení 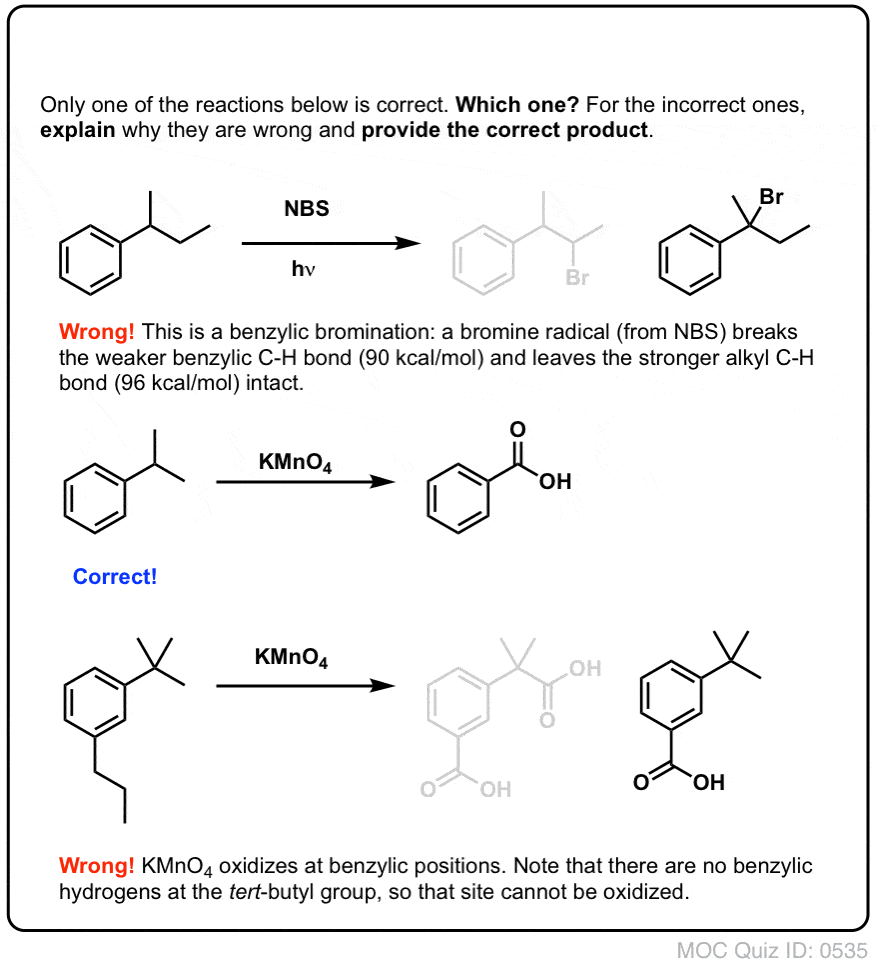
 Klikněte pro převrácení
Klikněte pro převrácení 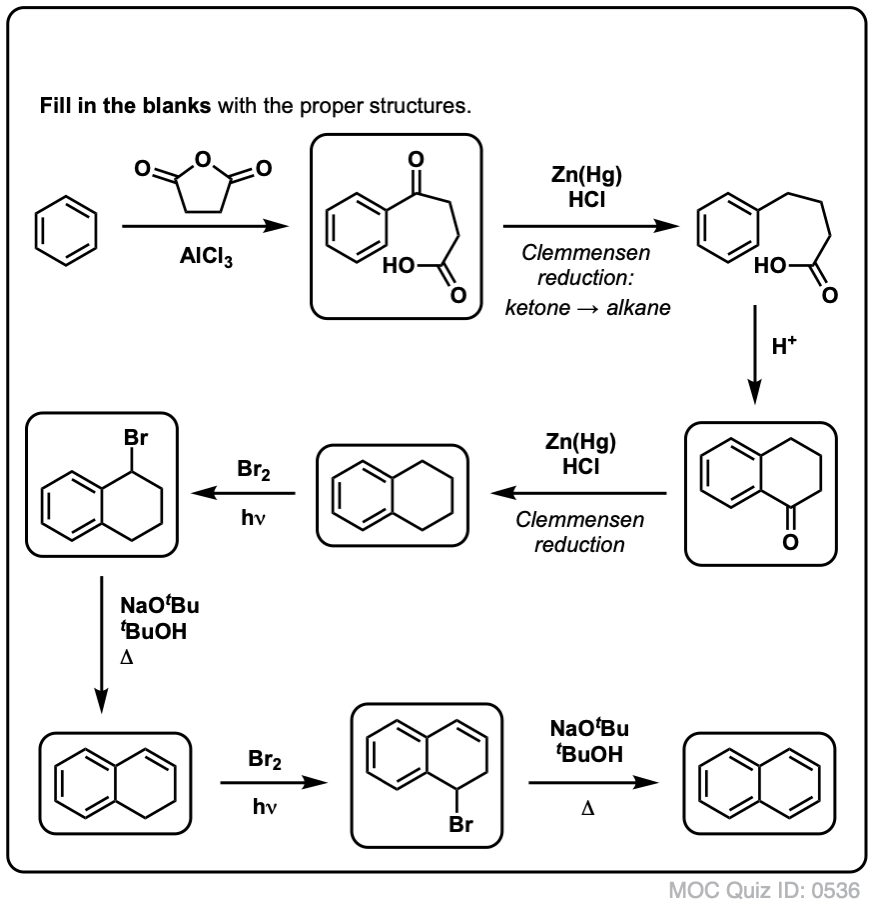
.
 Klikněte pro překlopení
Klikněte pro překlopení 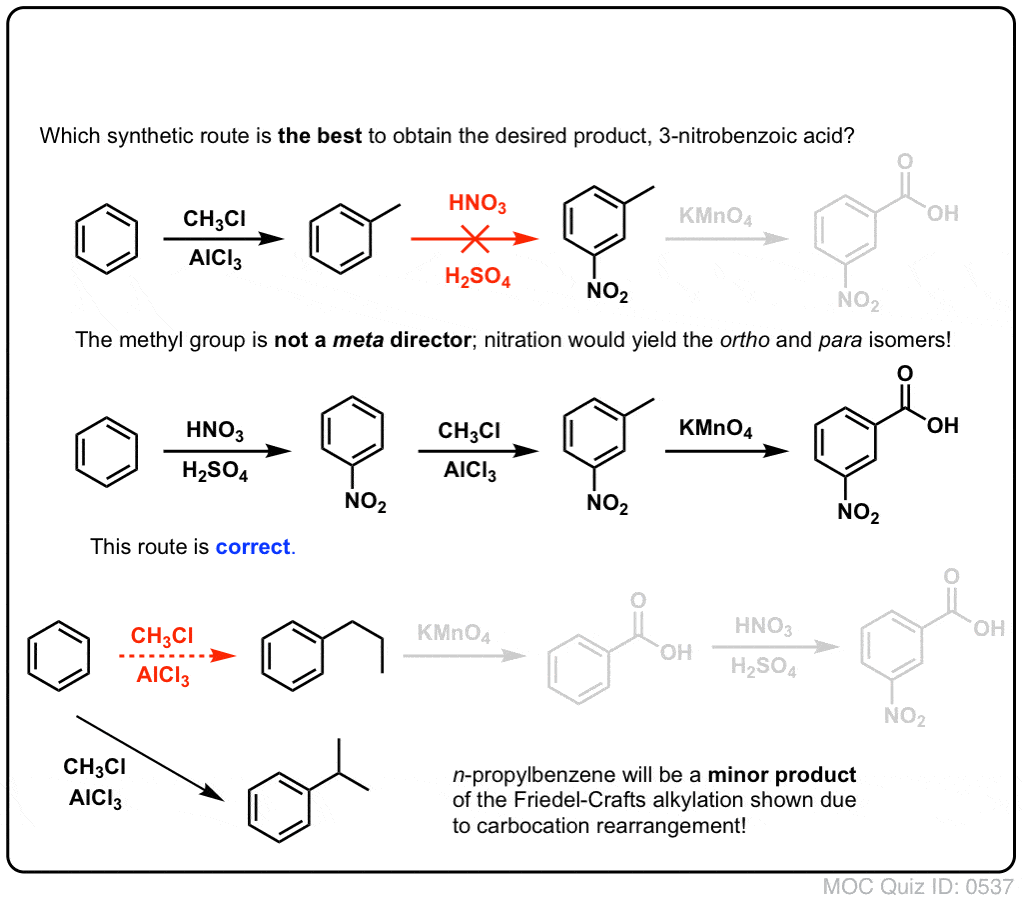
(pro pokročilé) Odkazy a další literatura
Benzylové bromování:
Tato reakce je také známá jako Wohl-Zieglerova reakce.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
První dvě publikace o této reakci. Wohl použil jako bromovací činidlo N-bromoacetamid, nikoli NBS. Ziegler poté provedl podrobnou studii a uvedl, že NBS lze použít jako vhodné bromovací činidlo pro allylickou bromaci. - Dibenzocyklookten: Vícegramová syntéza bidentátového ligandu
Géraldine Franck, Marcel Brill a Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Benzylové brominace s N-bromosukcinimidem v (trifluormethyl)benzenu
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
V odkazu č. 3 je uvedena typická benzylbromace pomocí NBS v CCl4, která byla z velké části vyřazena z důvodu obav z toxicity. Odkaz #4 ukazuje, že místo CCl4 lze pro benzylovou bromaci použít jako rozpouštědlo PhCF3. - Bromování pomocí N-bromosukcinimidu a příbuzných sloučenin. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Starší přehled o této reakci od známého chemika Carla Djerassiho, jehož hlavním přínosem pro světové zdravotnictví byl vývoj norethindronu – první ženské antikoncepce. - N-bromosuccinimid. III. Stereochemický průběh benzylové bromace
H. J. Dauben Jr. and Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Mechanistická studie stereochemie benzylové bromace. Pozorováním vzniku racemických benzylových bromidů z prochirálních substrátů se dále posiluje intermedialita radikálů v této reakci. - Tytéž odkazy z allylické brominace zde mohou být použity znovu:
- Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Benzylická bromace probíhá stejným mechanismem jako allylická bromace, jak vysvětluje tento článek.NBS (N-bromosukcinimid) je vhodným činidlem pro volnoradikálovou bromaci a následující práce jsou mechanistické studie zahrnující NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson a J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Tyto práce profesora J. C. Martina (UIUC) vznikly na počátku jeho kariéry, ještě předtím, než se věnoval práci, která ho nejvíce proslavila (studie „hypervalentních“ molekul, včetně vývoje „Dess-Martinova periodinanu“). - The Identity of the Chain-Carrying Species in Brominations with N-Bromosuccinimide: Selectivity of Substituted N-Bromosuccinimides toward Substituted Toluenes
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosukcinimid. Mechanisms of allylic bromination and related reactions
J. H. Incremona and James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidyl radical as a chain carrier. Mechanismus allylické bromace
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radical Bromination of Cyclohexene in CCl4 by Bromine: D. W. McMillen a John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Tento článek popisuje pečlivé kinetické studie, které ukazují, že nízká koncentrace Br2 (jakou poskytuje nečistý NBS) upřednostní radikálovou substituci před polární adiční reakcí. - o-XYLYLEN DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, s.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Spolehlivý postup pro benzylovou bromaci s Br2 in Organic Syntheses. - Bromování tetralinu. Short and Efficient Synthesis of 1,4-Dibromonaphthalene
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek and Keith Smith
Česky. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Vhodná syntéza 1,4-dibromonaftalenu z tetralinu, prostřednictvím benzylové bromace. benzylové oxidace:
Pro benzylovou oxidaci existuje mnoho strategií, včetně použití koncentrovaných roztoků KMnO4 nebo kyseliny chromové. - Kinetické studie oxidace aromatických sloučenin manganistanem draselným. Část IV. n- a iso-propylbenzen
C. F. Cullis a J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDINOVÉ DERIVÁTY X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook a S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Pokud je na benzylové pozici další substituent, pak oxidací vzniká místo karboxylové kyseliny keton. - Heterogenní permanganátové oxidace. 7. The Oxidation of Aliphatic Side Chains
Nazih A. Noureldin, Dongyuan Zhao, and Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagencie mohou být adsorbovány na pevné nosiče, aby se usnadnilo provádění reakcí a snížilo množství odpadu. V tomto případě se tím, že se činidlo KMnO4 stane heterogenním, reaktivita mírně změní, čehož lze využít pro některé chemoselektivní oxidace. pro oxidaci benzylových sloučenin lze použít mnoho dalších činidel, zde je výběr: - Selektivní oxidace na uhlíku sousedícím s aromatickými systémy s IBX
K. C. Nicolaou, Phil S. Baran a Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Raný článek od (nyní rockstar totální syntézy) Prof. Phila Barana (The Scripps Research Institute, La Jolla, CA), když byl ještě doktorandem ve skupině Prof. Nicolaoua. Ten používá IBX (hypervalentní I(V) činidlo) k benzylovým oxidacím, které probíhají radikálovým mechanismem. Jedná se o užitečnou reakci s širokým substrátovým rozsahem, jak ukazuje 25 příkladů v článku. - Přímá a selektivní benzylická oxidace alkylarenů pomocí C-H abstrakce s využitím bromidů alkalických kovů
Katsuhiko Moriyama, Misato Takemura a Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Tato práce využívá oxon jako terminální oxidant pro oxidaci benzylových sloučenin. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Tato práce využívá mesylperoxid jako oxidant pro selektivní oxidaci benzylových poloh na alkoholy. Vzniká benzylmesylát, který lze hydrolyzovat na alkohol. - Elektrochemická oxidace benzylových vazeb C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz a Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Benzylovou oxidaci lze provádět také pomocí elektrochemie. - Allylové a benzylové oxidační reakce s chloritanem sodným
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 je levný a lze jej použít i jako oxidant
.
Napsat komentář