Oblast výzkumu
On 23 listopadu, 2021 by adminPřehled bakteriálního sekrečního systému
Sekrece proteinů, transport proteinů z cytoplazmy do jiných částí buňky, prostředí a/nebo jiných bakterií či eukaryotických buněk, je jednou ze základních funkcí prokaryotické buňky. Prokaryota vyvinula řadu transportních proteinů mezi jednotlivými místy, které se do značné míry podílejí na pomoci specializovaných systémů sekrece proteinů. Systémy vylučování bílkovin jsou důležité pro růst bakterií a jsou užitečné v mnoha procesech. Bylo zjištěno, že některé sekreční systémy jsou téměř u všech bakterií a budou vylučovat širokou škálu substrátů, zatímco jiné byly nalezeny jen u několika bakteriálních druhů a podílejí se na vylučování pouze jednoho nebo několika málo proteinů. V některých případech bakteriální patogeny využívají tyto specializované sekreční systémy k manipulaci s hostitelem a budování replikační niky. Jindy tyto sekreční systémy využijí environmentální niku, aby pomohly bakteriím konkurovat okolním mikroorganismům. Existuje několik různých tříd bakteriálních sekrečních systémů a jejich konstrukce se liší podle počtu transmembrán v proteinovém substrátu.
Sekrece přes cytoplazmatickou membránu
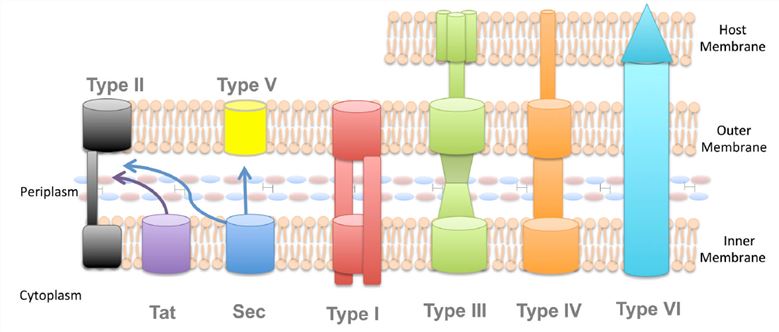
Existují dvě cesty, které jsou bakteriálními sekrečními systémy nejčastěji používanými k transportu proteinů přes cytoplazmatickou membránu: obecná sekreční cesta (Sec) a cesta translokace dvojčat argininu (Tat). Tyto dvě dráhy jsou považovány za nejvíce konzervované mechanismy sekrece proteinů a byly identifikovány ve všech doménách života (bakterie, archea a eukarya). U bakterií existují dráhy Sec a Tat v periplazmě nebo vnitřní membráně a transportují většinu proteinů. Proteiny v nesloženém stavu jsou přenášeny především cestou Sec. Tento systém se skládá ze tří částí: cílové složky proteinu, motorického proteinu a membránově integrovaného vodivého kanálu, který se nazývá SecYEG translokáza. Na rozdíl od dráhy Sec vylučuje dráha Tat především složený protein. Tato dráha je důležitá, protože ne všechny proteiny mohou být vylučovány v nesloženém stavu.
Sekrece proteinů gramnegativními bakteriemi
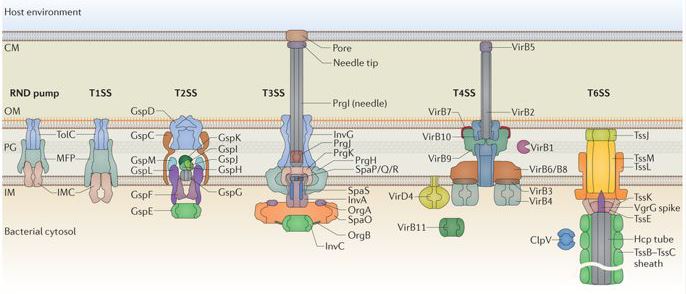
Na specializované sekreční systémy spoléhá řada gramnegativních bakterií při transportu proteinů virulence mimo buňku a v některých případech přímo do cytoplazmy cílové eukaryotické nebo prokaryotické buňky. Pro gramnegativní bakterie je vylučování extracelulárních proteinů výzvou, protože tyto proteiny musí projít dvěma nebo dokonce třemi fosfolipidovými membránami, aby nakonec dorazily na místo určení. Některé vylučované proteiny projdou těmito membránami ve dvou oddělených krocích, kdy jsou nejprve dopraveny do periplazmy prostřednictvím sekrečního systému Sec nebo Tat a poté jsou přeneseny přes vnější membránu druhým systémem, který je znám jako sekrece proteinů závislá na Sec nebo Tat. Kromě toho se k vylučování mnoha dalších proteinů prostřednictvím kanálů, které překlenují vnitřní i vnější bakteriální membránu, používá proces známý jako sekrece proteinů nezávislá na Sec nebo Tat. Tyto systémy u gramnegativních bakterií jsou číslovány od typu I po typ VI, přičemž každý systém podporuje specifickou podskupinu proteinů. β-barrel kanály se na nich podílejí v systémech, které tvoří prstenec ve vnější membráně bakteriální buňky, ale jinak vykazují značnou rozmanitost ve své struktuře a mechanistických funkcích.
Obrázek 1. Systémy sekrece u gramnegativních bakterií
Sekrece bílkovin grampozitivními bakteriemi
Na rozdíl od gramnegativních bakterií, které mají dvě fosfolipidové membrány, obsahují grampozitivní bakterie pouze jednu lipidovou dvojvrstvu a jsou pokryty velmi silnou buněčnou stěnou, která je podstatně tlustší než u gramnegativních bakterií. Kromě toho existují některé druhy grampozitivních bakterií, které obsahují buněčnou stěnu silně modifikovanou lipidy, tzv. mykomembránu. Vzhledem k těmto rozdílům v základní stavbě buňky je zřejmé, že mechanismy vylučování extracelulárních bílkovin se u grampozitivních a gramnegativních bakterií liší. Podobně jako gramnegativní organismy spoléhají grampozitivní bakterie při transportu proteinů přes cytoplazmatickou membránu na dráhu Tat i Sec. Ve většině případů to však k dopravení proteinů na místo určení nestačí. Podobně jako u jejich gramnegativních protějšků jsou i u grampozitivních patogenů proteiny, které jim pomáhají přežít během infekce savčího hostitele, exprimovány na jejich vnějším povrchu. Tyto proteiny se musí zabudovat do buněčné stěny grampozitivních bakterií, aby se udržely na vnějším povrchu bakterie. K dosažení této funkce je u grampozitivních bakterií kódována třída enzymů, tzv. sortáz, které po sekreci přes cytoplazmatickou membránu kovalentně vytvářejí proteiny připojené k buněčné stěně. Tyto sortázy se liší svou specifičností, například „domácí“ sortázy, SrtA, mohou k buněčné stěně připojit až 40 proteinů, zatímco jiné sortázy jsou jedinečné pouze pro jeden nebo dva proteiny.
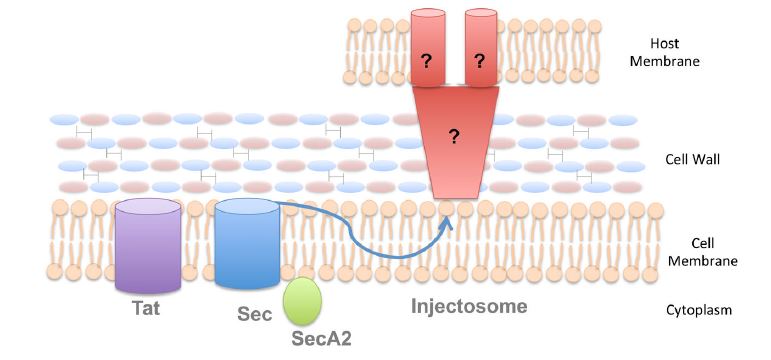
Obrázek 2. Systémy sekrece u grampozitivních bakterií
Napsat komentář