Jaké jsou dva typy iontů a čím se liší
On 28 prosince, 2021 by adminJaké jsou dva typy iontů a čím se liší

Iont:
Iont je kladně nebo záporně nabitý atom (nebo skupina atomů). Iont vzniká ztrátou nebo ziskem elektronů atomem, takže obsahuje nerovnoměrný počet elektronů a protonů.
Příklad: Iont vzniká ztrátou nebo ziskem elektronů atomem, takže obsahuje nerovnoměrný počet elektronů a protonů: Iont sodíku Na+, iont hořčíku Mg2+, chloridový iont Cl- a oxidový iont O2-.
Existují dva typy iontů :
- kationty
- anionty.

1. Kationt
Kladně nabitý ion se označuje jako kationt. Kationt vzniká ztrátou jednoho nebo více elektronů atomem.
Příklad: Příklad: Atom sodíku ztratí 1 elektron a vznikne sodný ion, Na+, který je kationtem :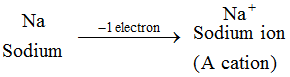 Ionty všech kovových prvků jsou kationty.
Ionty všech kovových prvků jsou kationty. 2. Aniont
2. Aniont
Záporně nabitý ion se nazývá aniont. Aniont vzniká ziskem jednoho nebo více elektronů atomem.
Příklad: Příklad: Atom chloru získá 1 elektron a vytvoří chloridový iont Cl-, který je aniontem.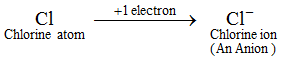 Aniont obsahuje více elektronů než normální atom. Normální atom (neboli neutrální atom) obsahuje stejný počet protonů a elektronů. Protože nyní vzniká aniont přidáním jednoho nebo více elektronů k atomu, obsahuje tedy aniont více elektronů než protonů. Ionty všech nekovových prvků jsou anionty.
Aniont obsahuje více elektronů než normální atom. Normální atom (neboli neutrální atom) obsahuje stejný počet protonů a elektronů. Protože nyní vzniká aniont přidáním jednoho nebo více elektronů k atomu, obsahuje tedy aniont více elektronů než protonů. Ionty všech nekovových prvků jsou anionty. Jednoduché ionty
Jednoduché ionty
Ty ionty, které vznikají z jednotlivých atomů, se nazývají jednoduché ionty.
Příklad:
Složené ionty
Ty ionty, které vznikají ze skupin spojených atomů, se nazývají složené ionty
Příklad: Ionty sodíku, Na+, jsou jednoduché ionty, protože vznikají z jediného atomu sodíku, Na:
Iontové sloučeniny
Sloučeniny, které jsou tvořeny ionty, se nazývají iontové sloučeniny. V iontové sloučenině jsou kladně nabité ionty (kationty) a záporně nabité ionty (anionty) drženy pohromadě silnými elektrostatickými přitažlivými silami. Síly, které drží ionty v iontové sloučenině pohromadě, se nazývají iontové vazby nebo vazby elektrolytické. Protože se iontová sloučenina skládá ze stejného počtu kladných a záporných iontů, je celkový náboj iontové sloučeniny nulový.
Příklad: Chlorid sodný (NaCl) je iontová sloučenina, která se skládá ze stejného počtu kladně nabitých sodných iontů (Na+) a záporně nabitých chloridových iontů (Cl-).
Některé iontové sloučeniny
|
S.No. |
Název | Formula |
Přítomné ionty |
|
1 |
Chlorid sodný | NaCl | Na+ a Cl- |
| 2 | Chlorid draselný | KCl |
K+ a Cl- |
|
3 |
Chlorid amonný | NH4Cl | NH4+ a Cl- |
|
4 |
Hořčík. chlorid | MgCl2 | Mg2+ a Cl- |
| 5 | chlorid vápenatý | CaCl2 | Ca2+ a Cl- |
| 6 | Oxid hořečnatý | MgO | Mg2+ a O2- |
| 7 | Oxid vápenatý | CaO | Ca2+ a O2- |
| 8 | Oxid hlinitý | Al2O3 | Al3+ a O2- |
| 9 | Hydroxid sodný | NaOH | Na+ a OH- |
| 10 | Síran měďnatý | CuSO4 | Cu2+ a SO42- |
| 11 | Dusičnan vápenatý | Ca(NO3)2 |
Ca2+ a NO3- |
.
Napsat komentář