Assessing Cell Health: Životaschopnost a proliferace
On 11 října, 2021 by adminČást I: Testy životaschopnosti a proliferace
Životaschopnost a proliferace
Životaschopnost a proliferace jsou dvě odlišné vlastnosti buněk. Životaschopnost je mírou počtu živých buněk v populaci, zatímco proliferace je mírou dělení buněk. Je třeba poznamenat, že ne všechny životaschopné buňky se dělí. Ačkoli lze proliferaci snadno interpretovat jako životaschopnost, neměla by být absence proliferace automaticky považována za známku buněčné smrti.
Ohodnocení životaschopnosti a proliferace
1. Propustnost membrán
Značkou mrtvých a odumírajících buněk je rozpad buněčných a jaderných membrán. Mnoho testů životaschopnosti využívá tuto vlastnost buněčné smrti k rozlišení životaschopných a neživotaschopných buněk.
Polární barviva na nukleové kyseliny, jako je DAPI, propidium jodid (PI) a 7-AAD, barví mrtvé buňky, protože tato barviva mohou vstoupit pouze do buněk s narušenými membránami. PI váže RNA i DNA, zatímco 7-AAD a DAPI interagují pouze s DNA. Tato barviva lze použít v kombinaci s testy, které detekují enzymatickou aktivitu, jako jsou esterázové substráty popsané v následujícím oddíle, nebo s indikátory životaschopnosti propustnými pro buňky, aby bylo možné označit živé a mrtvé buňky současně. Testy PI, DAPI a 7-AAD lze odečítat pomocí fluorescenčního mikroskopu, průtokového cytometru (obr. 1) nebo čtečky mikrotitračních destiček.
A.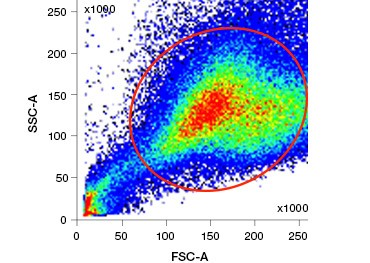
B.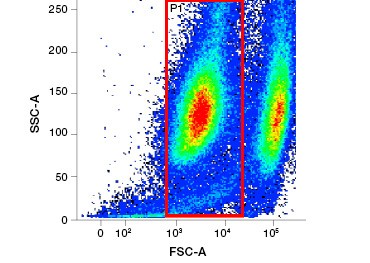
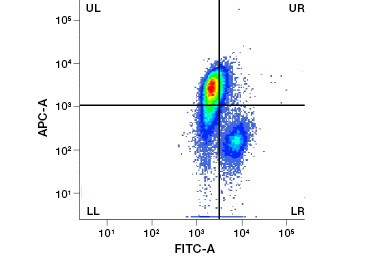
Obr. 1. Obr. 2. Testy PI, DAPI a 7-AAD. Barvení jodidem propidia zlepšuje identifikaci zájmových buněk. Gating živých buněk pomocí předního a bočního rozptylu nemusí stačit k odstranění mrtvých buněk a stále může být přítomna nespecifická vazba (A). Použití barviv životaschopnosti, jako je propidiumjodid, může pomoci odstranit nespecifickou vazbu (B). Makrofágy J774 byly obarveny na CD11b a CD3, přičemž červený kruh a obdélník označují strategii brány pro živé buňky.
Při použití těchto barviv je rozhodující načasování, protože podíl obarvených buněk se během barvení zvyšuje, protože buňky dále odumírají. Je třeba poznamenat, že žádné z těchto barviv není fixovatelné. Pro aplikace, které vyžadují fixaci, jsou vynikající volbou ethidium monoazidy nebo aminoreaktivní proteinová barviva.
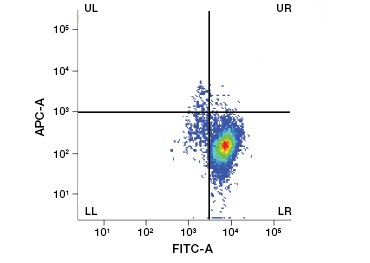
Buněčná nepropustná proteinová barviva jsou skvělou alternativou k barvivům nukleových kyselin, protože jsou méně toxická. Aminoreaktivní barviva se dodávají v širokém rozsahu excitačních a emisních spekter, a umožňují tak větší flexibilitu při navrhování panelů průtokové cytometrie a mikroskopie než barviva DNA. Další výhodou těchto proteinových barviv je, že jsou fixovatelná (obr. 2).
A.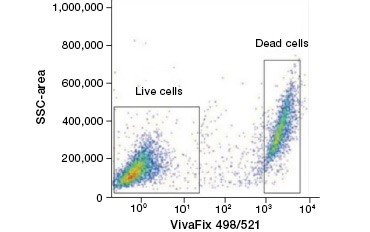
B.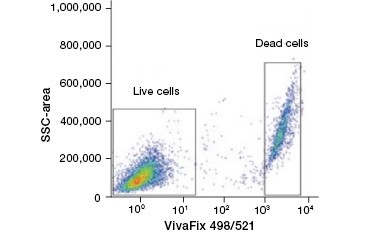
Obr. 2. Barevné barvení proteinů. Proteinová barviva rozlišují živé a mrtvé buňky. Pomocí testů životaschopnosti buněk VivaFix™ lze identifikovat a následně analyzovat populace živých a mrtvých buněk ve fixovaných (A) a nefixovaných (B) buňkách pomocí průtokové cytometrie.
Speciální úvaha při použití běžného proteinového barviva trypanová modř spočívá v tom, že toto barvivo obarví životaschopné buňky v průběhu času specifickým způsobem. Proto je velmi důležité optimalizovat protokoly pro trypanovou modř pro každý typ buněk a experiment.
Všechna tato barviva lze použít na jednotlivé buňky a tkáně a vyhodnotit je pomocí fluorescenční mikroskopie nebo průtokové cytometrie, ačkoli barvení trypanovou modří se častěji vyhodnocuje ručním počítáním buněk pomocí hemocytometru a mikroskopu.
Na rozdíl od barviv na nukleové kyseliny nepropustných pro buňky, barviva na nukleové kyseliny propustné pro buňky, jako je akridinová oranž, snadno difundují přes buněčné membrány a barví tak DNA životaschopných buněk. Neživotaschopné buňky nejsou účinně obarveny, protože jejich narušené membrány umožňují, aby z nich barvivo snadno difundovalo. Akridinová oranž je duální fluorescenční barvivo, které vyzařuje zelenou fluorescenci, když se váže na dsDNA, a červenou fluorescenci, když se váže na ssDNA a RNA. Při použití akridinové oranžové jako barviva vázajícího DNA mějte na paměti, že neváže účinně kondenzovaný chromatin. Jak je uvedeno v oddíle 6, toto barvivo lze také použít k posouzení schopnosti buněk udržovat kyselé pH v lysozomech, což je další ukazatel životaschopnosti buněk. Barviva propustná pro nukleové kyseliny lze použít k identifikaci a kvantifikaci životaschopných buněčných populací pomocí mikroskopie, průtokové cytometrie nebo testu na mikrotitračních destičkách.
Buněčná nepropustná a propustná barviva lze použít v kombinaci s fluorescenčně značenými protilátkami proti proteinům, které jsou předmětem zájmu, což usnadňuje zahrnutí klíčových kontrol životaschopnosti do každého experimentu. Klíčovým aspektem při použití těchto barviv k posouzení integrity membrán je skutečnost, že různé typy buněk mají různé charakteristiky propustnosti membrán. Například některá barviva DNA nepropouštějící buňky snadno obarví mrtvé eukaryotické buňky, ale nejsou schopna obarvit prokaryota s narušenými membránami.
Celost membrán lze také hodnotit pomocí enzymatických testů. Oblíbenou volbou je hodnocení úniku cytoplazmatického enzymu laktátdehydrogenázy (LDH) do kultivačního média při smrti buňky. Kolorimetrické testy LDH lze provádět ve formátu mikrotitračních destiček a odečítat pomocí mikrotitrační čtečky ELISA.
Rozpad membrán lze měřit také pomocí testů uvolňování chromu. Zde jsou buňky před experimentálním ošetřením předem označeny 51Cr. Chrom se váže na buněčné proteiny a po smrti buňky se uvolňuje do kultivačního média. Stanovením množství volného a vázaného 51Cr pomocí scintilačního čítače lze kvantitativně měřit buněčnou smrt. Buňky lze také předem označit fluorescenčními barvivy. Tyto metody někdy trpí vysokým pozadím kvůli spontánnímu uvolňování značek; jsou užitečné pouze pro aplikace, které umožňují předem označit buňky zájmu.
2. Enzymatická aktivita
Dalším klíčovým rozdílem mezi životaschopnými a neživotaschopnými buňkami je, že životaschopné buňky jsou enzymaticky aktivní. Esterázová aktivita měřená pomocí substrátů, jako je karboxyfluorescein diacetát (CFDA), se běžně používá jako ukazatel celkové enzymatické aktivity. CFDA je nefluorescenční barvivo propustné pro buňky, které je hydrolyzováno za vzniku fluorescenční molekuly karboxyfluoresceinu nespecifickými intracelulárními esterázami přítomnými pouze v životaschopných buňkách. Protože je karboxyfluorescein záporně nabitý, je v životaschopných buňkách nekovalentně zadržován, což vede k zelené fluorescenci.
CFDA-SE je derivát CFDA, který je po hydrolýze lépe zadržován. Jeho produkt, CFSE, má sukcinimidylesterové skupiny, které tvoří kovalentní vazby s primárními aminy intracelulárních proteinů, což umožňuje dlouhodobé sledování životaschopnosti buněk. Protože se CFSE kovalentně udržuje v buňkách, je spolehlivějším ukazatelem životaschopnosti buněk a oblíbeným měřítkem buněčné proliferace, protože jeho fluorescence se při každém dělení buněk snižuje na polovinu (obrázek 3). Vylepšení CFDA-SE byla provedena s proliferačními barvivy, která mají větší retenci v buňkách, poskytují větší rozlišení buněčného dělení a jsou k dispozici v širokém rozsahu excitačních a emisních spekter, což umožňuje začlenění do vícebarevných fluorescenčních aplikací, jako je průtoková cytometrie.
A.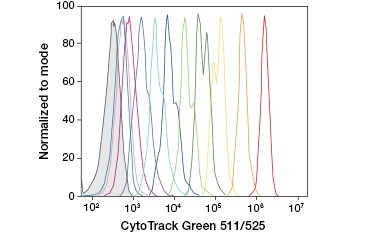
B.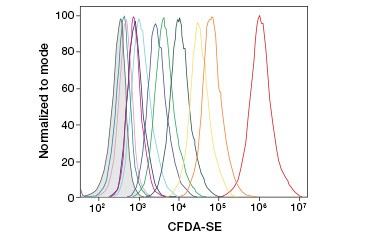
Obr. 3. Fluorescenční barvivo CFSE. Sledování generací buněk pomocí průtokové cytometrie. Deset buněčných generací lze rozlišit pomocí testu CytoTrack™ Green 511/525 Cell Proliferation Assay (A) a až osm pomocí CFDA-SE (B).
K dispozici je mnoho dalších fluorescenčních esterázových substrátů, jako jsou deriváty kalceinu a BCECF, s různými vlastnostmi, včetně rozdílů v excitačním/emisním spektru. Protože fluorescence BCECF je citlivá na pH, může také sledovat změny cytosolického pH.
Při použití esterázových substrátů propustných pro buňky lze životaschopnost hodnotit pomocí fluorescenční mikroskopie a průtokové cytometrie. Tyto substráty lze také aplikovat na vzorky tkání nebo použít ve vysokokapacitních mikrotitračních testech.
3. Metabolická aktivita
Dalším běžným měřítkem životaschopnosti buněk je metabolická aktivita, kterou lze hodnotit pomocí oxidovatelných a redukovatelných sond.
Resazurin je oblíbeným oxidačně-redukčním (redoxním) indikátorem. Toto barvivo propustné pro buňky lze přidat přímo do média buněčné kultury, což z něj činí rychlý a pohodlný test. V metabolicky aktivních buňkách se modrý a slabě fluoreskující resazurin redukuje za vzniku růžové a vysoce fluoreskující molekuly resorufinu. Tuto změnu lze sledovat pomocí fluorescenčních i kolorimetrických testů. Protože množství fluorescence je přímo úměrné počtu živých, dýchajících buněk, je resazurin široce používán ke kvantitativnímu měření životaschopnosti buněk. Resazurin je vhodnou, citlivější a stabilnější a netoxickou alternativou jiných redoxních indikátorů, jako jsou tetrazolové soli MTT a XTT. Na rozdíl od testů založených na tetrazoliových solích, které jsou kolorimetrické a lze je odečítat pouze pomocí čtečky mikrodestiček, lze testy životaschopnosti resazurinu odečítat pomocí průtokové cytometrie nebo fluorescenční mikroskopie. Resazurin a tetrazoliové soli jsou zvláště užitečné pro vysoce výkonné aplikace, protože životaschopnost lze hodnotit na mikrotitračních destičkách pomocí mikrotitrační čtečky (obrázek 4). XTT se často volí místo MTT pro aplikace s vyšší propustností, protože na rozdíl od MTT poskytuje barvivo rozpustné ve vodě, čímž odpadá krok solubilizace, který je pro testy MTT zásadní. Resazurin a tetrazoliové soli se nejčastěji používají k hodnocení životaschopnosti adherentních buněk a buněk v roztoku.
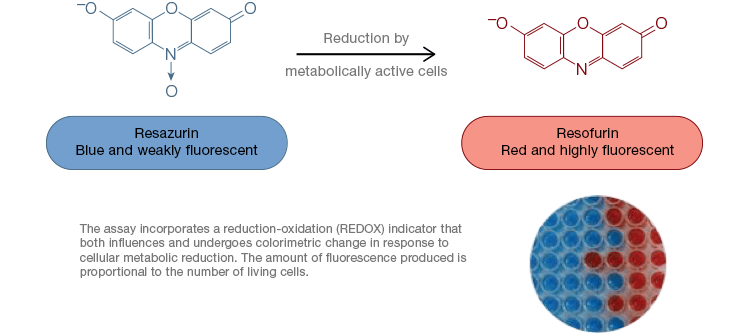
Obr. 4. K hodnocení životaschopnosti buněk v roztoku se nejčastěji používá resazurin a tetrazoliové soli. Netoxické testy oxidace resazurinu jsou snadno škálovatelné pro vysoce výkonné aplikace. Oxidace alamarBlue v metabolicky aktivních buňkách vede ke kolorimetrické změně z modré na červenou a také ke zvýšení fluorescence.
Dihydrorhodaminy, -kalceiny a -fluoresceiny jsou redukované deriváty rodaminu, -kalceinu a -fluoresceinu, které jsou propustné pro buňky a bezbarvé. Tyto sloučeniny jsou snadno oxidovány na své fluorescenční mateřské barvivo reaktivními formami kyslíku přítomnými v živých buňkách a tkáních.
Další třídou testů životaschopnosti, které měří metabolickou aktivitu, jsou luminiscenční testy ATP. Ty kvantifikují ATP uvolněný buňkami při lýze. Nevyžadují dlouhou inkubační dobu, jsou velmi citlivé a běžně se odečítají pomocí čtečky mikrotitračních destiček.
Jedním faktorem, který je třeba vzít v úvahu při použití testů měřících metabolickou aktivitu, je skutečnost, že metabolická aktivita se může za různých podmínek buněčné kultury lišit. Je proto třeba zahrnout vhodné kontroly, které tyto rozdíly zohlední.
4. Syntéza/replikace DNA
Dalším měřítkem životaschopnosti a oblíbenou metodou hodnocení proliferace je kvantifikace inkorporace BrdU do nově syntetizované DNA. DNA obsahující BrdU se identifikuje pomocí konjugovaných protilátek proti BrdU nebo protilátek proti BrdU v kombinaci s konjugovanou sekundární protilátkou (obrázek 5). Tyto testy umožňují různé způsoby odečtu, protože protilátky mohou být spojeny s různými typy indikátorů (fluorofory, peroxidázy atd.). Značení specifických buněčných markerů protilátkami rovněž umožňuje rozlišit specifické proliferující populace. Vzorky se po inkubaci fixují a poté analyzují pomocí průtokové cytometrie, fluorescenční mikroskopie, imunohistochemie nebo mikrotitračních čteček. Pomocí průtokové cytometrie lze buňky zařadit do G0/G1, S nebo G2/M fáze buněčného cyklu na základě celkového obsahu DNA. Použití chromogenních peroxidázových substrátů umožňuje odečítat testy bez fluorometru. A použitím -TdR namísto BrdU lze tyto testy převést na odečítání radioaktivních značek.
A.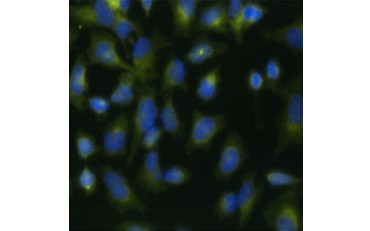
B.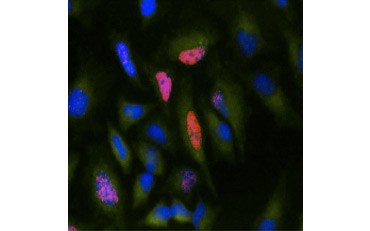
Obr. 5. V případě, že se v testu používá -TdR namísto BrdU, lze tyto testy převést na odečítání radioaktivních značek. Vizualizace inkorporace BrdU. Buňky HeLa byly ošetřeny 10 µg BrdU po dobu 1 hodiny (B) nebo ponechány bez ošetření (A). Buňky byly obarveny myší protilátkou proti BrdU, klon Bu20a (MCA2483; ředění 1:25) a jako sekundární protilátka byla použita kozí protilátka proti myšímu IgG (H/L) konjugovaná s DyLight 549 (červená) (STAR117D549GA; ředění 1:50). Cytoplazma byla obarvena králičí protilátkou Anti-GAPDH (AHP1628; ředění 1:100) a jako sekundární protilátka byla použita ovčí protilátka Anti-Rabbit IgG konjugovaná s DyLight 488 (zelená) (STAR36D488GA; ředění 1:50). Jako jaderné protibarvivo byla použita PureBlu™ DAPI (1351303).
5. Exprese markerů proliferace
Je známo, že exprese některých proteinů se během buněčné proliferace zvyšuje. Například Ki-67 je exprimován v jádře dělících se buněk, ale není detekovatelný během G0 a G1 (obr. 6). Podobně lze k identifikaci buněk ve fázi M použít fosforylaci histonu H3. Mezi další běžně používané markery proliferace patří jaderný antigen proliferujících buněk (PCNA) a minichromosome maintenance 2 (MCM2). Pomocí protilátek proti těmto a dalším klíčovým proliferačním markerům nebo markerům buněčných linií lze hodnotit pomocí ELISA, průtokové cytometrie, imunohistochemie, fluorescenční mikroskopie a Western blottingu.
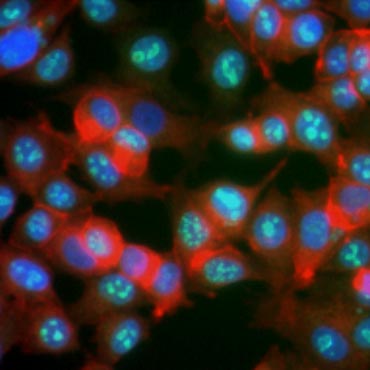
Obr. 6. Proliferační markery. Protilátky proti Ki-67 identifikují proliferující buňky. Barvení buněk MCF-7 lidskou protilátkou proti Ki-67 (HCA006, zelená) kontrastně barvenou falloidinem (červená) a Hoechstem (modrá).
6. Membránový potenciál a pH
Živé buňky aktivně udržují iontové gradienty přes své membrány a vytvářejí transmembránové potenciály. Když buňka zemře, jsou tyto iontové gradienty narušeny. To lze posoudit pomocí potenciometrických barviv. JC-1 je běžně používané potenciometrické barvivo. Ve zdravých buňkách se JC-1 lokalizuje v mitochondriích, kde tvoří červené fluorescenční agregáty. Po rozpadu mitochondriálního membránového potenciálu JC-1 difunduje do celé buňky a existuje jako zeleně fluoreskující monomer. Tetramethylrhodamin ethyl estery (TMRE) a tetramethylrhodamin methyl estery (TMRM) se stejně jako JC-1 lokalizují v mitochondriích ve zdravých buňkách a v cytoplazmě v umírajících buňkách. Na rozdíl od JC-1 tato barviva nevykazují posun ve svých emisních spektrech. Místo toho má permeabilizace vnější mitochondriální membrány za následek pokles červené fluorescence TMRM/TMRE.
Živé buňky jsou schopny vytvářet a udržovat nízké pH v kyselých organelách buňky, jako je lysozom. To lze měřit pomocí acidotropních barviv, jako je akridinová oranž a neutrální červeň. Při použití akridinové oranžové je třeba vzít v úvahu, že toto barvivo váže také DNA a RNA. Po navázání na jednovláknové nukleotidy fluoreskuje akridinová oranž červeně, po navázání na dvouvláknovou DNA fluoreskuje zeleně a po navázání na DNA v lysozomu fluoreskuje oranžově.
Bez ohledu na zvolenou metodu je při provádění jakýchkoli zde popsaných testů velmi důležité zahrnout vhodné kontroly, protože experimentální podmínky a typ buněk mohou změnit výsledky některých testů. Vždy zahrňte pozitivní a negativní kontroly. Při použití sond v rozpouštědlech zahrňte také kontroly ošetřené vehikulem, abyste zohlednili účinky rozpouštědla. Ke kontrole faktorů, jako je autofluorescence při imunofluorescenci a experimentech s průtokovou cytometrií, a ke kontrole zatížení při Western blottingu použijte kontroly specifické pro danou aplikaci.
Informace o testech životaschopnosti a proliferace buněk společnosti Bio-Rad naleznete na naší stránce věnované buněčnému zdraví.
Přečtěte si část II Hodnocení zdraví buněk: Apoptóza
AlamarBlue je ochranná známka společnosti Trek Diagnostic Systems. DyLight je ochranná známka společnosti Thermo Fisher Scientific.
Napsat komentář