Combinação de Ledipasvir e Sofosbuvir para Tratamento da Infecção pelo Vírus da Hepatite C Genótipo 1: Revisão Sistemática e Meta-Análise | Anais de Hepatologia
On Janeiro 20, 2022 by adminIntrodução
entre os aproximadamente 80 milhões de indivíduos no mundo com infecção crônica pelo vírus da hepatite C (HCV), cerca de 46% estão infectados com o genótipo 1 do HCV, o mais difícil de tratar com regimes baseados em interferon.1 Devido à baixa taxa de sucesso do tratamento e aos efeitos colaterais esperados de Pegylated-Interferon (PegIFN) e Riba-virin (RBV) para tratamento de pacientes infectados pelo HCV, esforços foram feitos para desenvolver regimes de tratamento livres de IFN.2,3
Regimes contendo inibidor de protease (PI) para pacientes com infecção pelo genótipo 1 do HCV foram introduzidos em 2011. No entanto, houve algumas interações medicamentosas associadas a regimes contendo PI e também devem ser usados com PegIFN e tiveram muitos efeitos colaterais.4 O tratamento de pacientes com infecção pelo genótipo 1 do HCV foi revolucionado pela introdução de agentes antivirais de ação direta (DAAs) recentes, incluindo Sofosbuvir (SOF); um inibidor analógico de nucleotídeos da polimerase NS5B e Ledipasvir (LDV) do HCV; um inibidor da proteína NS5A codificada pelo HCV.5,6 A melhor opção de tratamento é a que tem a maior taxa de resposta virológica sustentada (RVS) com o mínimo de efeitos adversos na duração mais curta do tratamento. A combinação de SOF/LDV por 12 ou 24 semanas com ou sem RBV aumentou a taxa de SVR até 95%-100% em pacientes inexperientes e com o genótipo 1 de infecção pelo HCV.7 Há necessidade de determinar a taxa exata de SVR para tratamento com SOF/LDV em combinação com ou sem RBV com duração de 12 ou 24 semanas. Além disso, o efeito de alguns fatores, como cirrose, história prévia de tratamento e substituições associadas à resistência NS5A (EARs) sobre a taxa de RVS com o referido regime deve ser avaliado.
Uma meta-análise dos estudos atualmente disponíveis foi realizada com o objetivo de avaliar a eficácia antiviral da terapia combinada SOF/LDV por 12 ou 24 semanas com ou sem RBV em pacientes com infecção pelo genótipo 1 do HCV.
Material and MethodsData resources and search strategies
Nesta meta-análise, pesquisamos de forma abrangente e sistemática bases de dados eletrônicas incluindo PubMed, Scopus, Science Direct e Web of Science usando estratégias de pesquisa apropriadas para cada base de dados. O foco das palavras-chave em nossas estratégias de busca foram os protocolos de tratamento; SOF, LDV e suas alternativas apropriadas. Além disso, para encontrar quaisquer possíveis literaturas cinzentas existentes, fizemos uma pesquisa no Google scholar e após encontrar títulos relacionados, continuamos nossa pesquisa até encontrar 200 títulos em série não relacionados. Além disso, as referências das publicações recuperadas também foram pesquisadas para identificação de possíveis publicações perdidas na pesquisa eletrônica. Nossa última pesquisa foi realizada em 2 de setembro de 2015 e nenhuma limitação linguística foi considerada. Uma atualização em nossa pesquisa foi realizada em 16 de março de 2016.
Critérios de elegibilidade
Any paper que avaliou o efeito da terapia combinada com SOF/LDV com ou sem RBV por 12 ou 24 semanas sobre a RBV, 12 semanas após o término do tratamento (SVR12) entre pacientes com infecção pelo genótipo 1 do HCV foram incluídas nesta meta-análise. Os estudos com os dados para análise de intenção de tratamento foram incluídos, caso contrário o trabalho foi excluído. Os seguintes itens foram considerados como nossos critérios de exclusão: pacientes em hemodiálise, pacientes com história prévia de tratamento baseado em SOF, pacientes com infecção simultânea pelo vírus da imunodeficiência humana (HIV), pacientes com cirrose descompensada (Child-Pugh B e C8) e história de transplante hepático ou renal.
Seleção do estudo, avaliação da qualidade e extração de dados
Baseado na diretriz PRISMA para relato de revisão sistemática,9 todos os artigos dos resultados da pesquisa foram revisados independentemente por duas pessoas (MSR-Z e KH) em cada nível de triagem (título, resumo e texto completo). Ao final de cada nível de triagem, quaisquer desacordos entre esses dois autores foram resolvidos por discussão mútua. Contudo, os desacordos remanescentes foram resolvidos por consenso e discussão com outros colegas (BB, SMA e HS).
A ferramenta de avaliação do risco de viés do Cochrane foi utilizada para avaliação da qualidade de cada um dos artigos incluídos10 e os seguintes riscos de viés foram avaliados: geração de sequência aleatória (viés de seleção), ocultação de alocação (viés de seleção), ocultação de participante e pessoal (viés de desempenho), ocultação de avaliação de resultados (viés de detecção), co-intervenções, dados incompletos de resultados (atrito), relato seletivo (viés de relato), análise de intenção de tratamento, similaridade de grupo na linha de base, conformidade, momento das avaliações de resultados e outros viés. Com base nessa avaliação, cada trabalho é classificado como de alto, pouco claro e baixo risco de vieses. Os riscos altos e pouco claros foram classificados como risco zero e o risco baixo como um. Os artigos com pontuação superior a 6 foram classificados como estudos de baixo risco. Novamente quaisquer diferenças ou discordâncias foram resolvidas por discussão mútua.
Dados de acompanhamento para participantes de cada braço dos estudos incluídos foram extraídos; gênero, genótipo do HCV, cirrose, polimorfismos próximos ao IFNL3 (rs12979860), histórico de tratamento anterior, duração do tratamento, idade, índice de massa corporal (IMC) e nível de RNA do HCV antes do tratamento. Além disso, alguns dados para cada estudo, incluindo ano de publicação, tamanho da amostra e nome do país foram coletados.
Análise de dados
Intervalo de confiança (IC) para a taxa de SVR em cada estudo foi calculado com base no método jeffreys e a quantidade média de limites superior e inferior de IC foi considerada como estimativa pontual para SVR.11 O teste de heterogeneidade foi realizado utilizando χ2 e I-quadrado (varia de 0% a 100%). O valor de P inferior a 0,1 foi considerado estatisticamente significativo para χ2. De acordo com o resultado do teste de heterogeneidade, utilizamos modelos de efeito fixo ou aleatório para a determinação do SVR12 agrupado, intervalo de confiança de 95% e valor de P. O método Trim and fill foi aplicado para superar o possível viés de publicação existente.12 STATA 10 foi utilizado para realizar todas as partes da análise dos dados.
ResultsStudy screening
Um total de 606 artigos foram identificados através de busca na base de dados. Após a remoção das duplicações, 459 artigos permaneceram para triagem. A Figura 1 mostra o número de artigos em cada nível de triagem. Dois outros artigos também foram encontrados através da atualização da pesquisa. Vinte artigos de texto completo foram avaliados para elegibilidade e finalmente dez artigos foram incluídos em nossa síntese quantitativa (meta-análise).
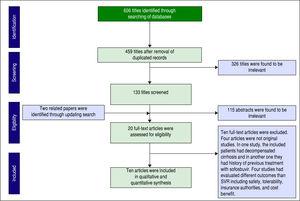
Processamento de artigos baseados na declaração PRISMA.
Risco de avaliação de enviesamento
Considerando a tabela 1, todos os estudos incluídos foram categorizados como de baixo risco (com pontuação superior a 7) e, portanto, nenhum estudo foi excluído com base na avaliação da qualidade.
Risco de avaliação de viés para os estudos incluídos.
| Primeiro autor (Referência) | Geração de sequência aleatória (Viés de selecção) | Ocultação de afectação (Viés de selecção) | Bloqueio de participante e pessoal (Viés de desempenho) | Vibração de avaliação de resultados (Viés de detecção) | Dados de resultados incompletos (Atração) | Relato seletivo (Viés de relatório) | Co-intervenções | Intenção de tratar análises | Semelhança do grupo na linha de base | Conformidade | Avaliação dos resultados | Outros vieses | Partitura | Conclusão | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | >Baixo | |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | >Baixo | |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | >Baixo | |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | >Baixo | |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | >Baixo | |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | >Baixo | |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | 10 | Baixo | |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | 8 | 8 | Baixo |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | >Baixo | |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Baixo |
Características dos estudos incluídos
Baseado no objectivo deste estudo, mostramos as características de cada um dos braços dos papéis incluídos na tabela 2 (combinação de SOF/LDV) e tabela 3 (combinação de SOF/ LDV/RBV).
Características dos Estudos Incluídos para Combinação de Sofosbuvir mais Ledipasvir.
| Primeiro Autor (Referência) | História do Tratamento Anterior | Ano de Publicação | País | Tamanho da amostra | Idade Média (SD ou intervalo) | Gênero Masculino (%) | Imacho BMI (SD ou intervalo) | Duração do tratamento (Wks) | RNA do HCV médio, Log IU/mL (SD) | Cirrose (%) | rs12979860 CC/CT+TTTa | HCV Genótipo 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0,44) | 22 (20) | 0,1 | 3,73 |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0,69) | 34 (16) | 0,34 | 2,18 |
| Gane, E.J.13 | TE | 2014 | Nova Zelândia | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6,5 (0,6) | 10 (100) | 0,11 | 4 |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0,8) | 0 (0) | 0,35 | 3,9 |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11,6) | 11 (58) | 28,1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6.6) | 15 (79) | 31.4 (4.7) | 12 | 6,3 (0,5) | 11 (58) | 0,11 | 18 |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | até 20% | >0.33 | 1.22 |
| Mizokami, M.20 | MIX | 2015 | Japão | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6,6 (0,5) | 41 (24) | 1,011 | 0,042 |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0,68) | 5 (12) | 5 | 0,10 |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0,55) | 4 (9) | 1,26 | 0,16 |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0,57) | 22 (20) | 0,17 | 3,54 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0,68) | 33 (15) | 0,31 | 2,14 |
| Bourliere, M.21 | TE | 2015 | França | 78 | 57 (10,7) | 56 (72) | 26,3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
Característica dos estudos incluídos para combinação de sofosbuvir mais ledipasvir e ribavirina.
| Primeiro Autor (Referência) | História do Tratamento Anterior | Ano de Publicação | País | Tamanho da amostra | Idade Média (SD ou intervalo) | Gênero Masculino (%) | Imacho BMI (SD ou intervalo) | Duração do tratamento (Wks) | RNA do HCV médio, Log IU/mL (SD) | Cirrose (%) | rs12979860 CC/CT+TTT* | HCV Genótipo 1a/1b*** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0,54) | 22 (20) | 0,11 | 3,82 |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0,64) | 33 (15) | 0,53 | 2,55 |
| Gane, E.J.13 | TN | 2014 | Nova Zelândia | 25 | 45 (9.2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 |
| Gane, E.J.13 | TE | 2014 | Nova Zelândia | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 |
| Gane, E.J.13 | TE | 2014 | Nova Zelândia | 9 | 57 (5.2) | 8 (89) | 27.3 (0.5) | 12 | 27,3 (0,5) | 9 (100) | 0,2 | 3,5 |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9,8) | 14 (67) | 31,5 (7.3) | 12 | 6,2 (0,4) | 11 (52) | 0,05 | 3,2 |
| Mizokami, M.20 | MIX | 2015 | Japão | 170 | 59 (9.5) | 73 (43) | 23.3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 |
| Stedman, C.A.M.14 | MIX | 2015 | Nova Zelândia | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5.6-7.5) | 1 (7) | 0.4 | 2.5 |
| Bourliere, M.21 | TE | 2015 | França | 77 | 56 (7.4) | 58 (75) | 27.9 (5.5) | 12 | 6,5 (0,5) | 76 (98,7) | 0,05 | 1,71 |
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0,60) | 22 (20) | 0,19 | 3,82 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
>Avaliação do resultado do tratamento
Calculamos o SVR12 combinado para quatro regimes de tratamento do HCV, incluindo 12 semanas de SOF/LDV (A), 24 semanas de SOF/LDV (B), 12 semanas de SOF/LDV/RBV (C) e 24 semanas de SOF/LDV/RBV (D). Resumo dos resultados destas meta-análises foi mostrado na tabela 4.
- –
Regime de tratamento A (12 semanas de sofosbuvir mais ledipasvir). Foram encontrados dez braços em oito estudos que avaliaram o regime A (Tabela 2). Houve heterogeneidade significativa entre os resultados dos braços do estudo (χ2 = 35,01, P Figura 2A). Tanto o teste de Begg (P = 0,074) quanto o teste de regressão linear de Egger (P
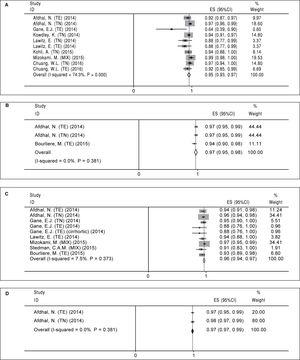 Figure 2.
Figure 2.Pooled SVR12 for Sofosbuvir plus Ledipasvir Regimen by Treatment Duration and Addition of Ribavirin. A. SVR12 combinado para 12 semanas de tratamento com sofosbuvir mais Ledipasvir. B. SVR12 combinado por 24 semanas de tratamento com sofosbuvir mais ledipasvir. C. SVR12 combinado durante 12 semanas de tratamento com sofosbuvir mais ledipasvir e ribavirina. D. SVR12 combinado para 24 semanas de tratamento com sofosbuvir mais ledipasvir e ribavirina. TE: experiência de tratamento. TN: tratamento naïve.
(0.39MB).- –
Regime de tratamento B (24 semanas de sofosbuvir mais ledipasvir). Para o regime de tratamento B, encontramos apenas três braços em três papéis (Tabela 2). Não foi encontrada heterogeneidade significativa em relação aos estudos relacionados a este regime (χ2 = 1,92, P = 0,38, I-quadrado = 0%). Com base em um modelo de efeito fixo, o pool SVR12 para o regime B foi de 97% (95%CI = 95%-98%) (Figura 2B). Dado que o número de estudos incluídos foi pequeno (n = 3), não realizamos testes relacionados para o viés de publicação.
- –
Regime de tratamento C (12 semanas de sofosbuvir mais ledipasvir e ribavirina). Nove braços de estudo em sete artigos foram encontrados para este tipo de regime (Tabela 3). Como não foi encontrada uma heterogeneidade significativa (χ2 = 8,64, P = 0,37, I-quadrado = 7,5%), foi utilizado o modelo de efeito fixo e o SVR12 combinado calculado como 96% (95%CI = 94%-97%) (Figura 2C). Houve viés de publicação baseado nos testes Begg’s (P = 0,009) e Egger’s linear regression (P = 0,001). Com base no método de aparar e preencher o SVR12 foi calculado como 96% (95%CI = 94%-97%).
- –
Regime de tratamento D (24 semanas de sofosbuvir mais ledipasvir e ribavirina). Como mostra a tabela 3, havia dois braços de estudo em dois trabalhos para este regime. Não houve heterogeneidade significativa nos resultados destes dois estudos (χ2 = 0,77, P = 0,38, I-quadrado = 0%) e de acordo com o modelo de efeito fixo, o SVR12 combinado foi calculado como 98% (95%CI = 97%-99%) (Figura 2D). Devido ao pequeno número de estudos incluídos (n = 2) não foi possível executar os testes relacionados para viés de publicação.
Tabela 4.Sumário de meta-análises da taxa de resposta virológica sustentada para combinação de sofosbuvir e ledipasvir.
Regimen Uso de Ribavirin Duração do tratamento (Wks) SVR Taxa (%) 95%CI (%) A Não 12 95 93-97 >
B Não 24 97 95-98 C Sim 12 96 94-97 D Sim 24 98 97-99 SVR: resposta virológica sustentada. CI: intervalo de confiança.Efeito dos parâmetros de linha de base na resposta virológica sustentada
- –
Cirrose. Na maioria dos braços de estudo para estes quatro regimes de tratamento mencionados, os pacientes eram cirróticos ou não cirróticos e, portanto, não podíamos fazer uma meta-análise de odds ratio (OR). Contudo, combinámos os dados de cada braço relacionados com cada regime de tratamento e finalmente calculámos o OR para o efeito da cirrose na SVR12 utilizando o método Peto. Considerando a Figura 3A, apenas no regime de tratamento A, a cirrose teve um efeito significativo na SVR12 (OR = 0,21, IC 95% = 0,07-0,66).
 Figure 3.
Figure 3.Efeito da cirrose e história prévia de tratamento na resposta virológica sustentada para sofosbuvir mais regime de ledipasvir. A. Efeito da cirrose sobre a resposta virológica sustentada. B. Efeito da história anterior do tratamento na resposta virológica sustentada.
(0.17MB).- –
História anterior do tratamento. Avaliamos o efeito do histórico anterior do tratamento sobre o SVR12. A Figura 3B mostra dados combinados relacionados a cada regime de tratamento e ORs (de acordo com o método Peto) relacionados com o efeito do histórico de tratamento anterior. Com base nesta análise, a história prévia do tratamento não teve efeito significativo na SVR12 em todos os regimes.
- –
NS5A substituições associadas à resistência. Os dados referentes aos RASs NS5A foram extraídos dos estudos incluídos que avaliaram os RASs na linha de base. Como os dados sobre este assunto não estavam disponíveis para avaliação de cada regime (A, B, C e D), inevitavelmente investigamos o efeito dos RAS sobre o regime principal SOF/ LDV com ou sem RBV durante 12 ou 24 semanas. Dados de três artigos não foram incluídos nesta análise; Gane, et al.13 por causa da adição de outro medicamento (GS-9669) ao esquema SOF/LDV em dois braços do estudo, Stedman, et al.14 por causa da indisponibilidade de dados de avaliação de SAR sobre SVR e Kohli, et al.15 por causa do relato de dados inadequados sobre o número de pacientes com SVR e SARS NS5A. Além disso, Kowdley e colaboradores6 avaliaram o efeito do SOF/LDV durante 8 semanas em um braço do seu estudo e como não conseguimos separar os dados relatados sobre SARS NS5A e SVR deste braço, extraímos todos os dados deste estudo e os incluímos nesta meta-análise. De acordo com a Figura 4, os NS5A RASs tiveram um efeito de redução significativo na RVS em regime SOF/LDV (OR = 0,31, 95% CI = 0,2-0,5). Não houve heterogeneidade entre os resultados dos estudos em relação à detecção de SARs NS5A na linha de base e na resposta ao tratamento. Também, com base nos testes de Begg (P = 0,65) e Egger (P = 0,67), não foi encontrado viés de publicação.
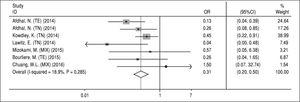 Figure 4.
Figure 4.Efeito das substituições associadas à resistência NS5A na resposta virológica sustentada para o regime de sofosbuvir mais ledipasvir.
(0.12MB).Discussão
A meta-análise atual mostrou a alta eficácia da terapia combinada SOF/VE em pacientes com infecção crônica pelo genótipo 1 da hepatite C. O padrão anterior de cuidados para o tratamento da infecção pelo genótipo 1 do HCV foi PegIFN e VBV com menos de 60% de VSR em pacientes com infecção pelo genótipo 1 do HCV e o tratamento acompanhado de muitos efeitos colaterais.16
O reconhecimento das proteínas-chave no ciclo de replicação do HCV proporcionou a oportunidade de visar essas proteínas e inibir a produção de viriões.17 Os regimes de tratamento do HCV tiveram uma longa história desde regimes baseados no IFN até regimes livres de IFN. Isto proporcionou um regime de tratamento com alta taxa de SVR, curta duração do tratamento e pequeno número de eventos adversos. O objetivo de se ter um regime de tratamento livre de IFN para infecção pelo genótipo 1 do HCV foi alcançado com a introdução e aprovação do regime SOF/LDV em 2014.18
O SOF/LDV pode ser usado com ou sem RBV e em diferentes durações de tratamento (12 ou 24 semanas).7 Alguns fatores importantes podem ser considerados para escolher um regime apropriado, como a existência de cirrose e contra-indicação do RBV. Entretanto, o custo deste regime é outro fator considerável para a escolha da duração do tratamento. Curiosamente, no presente estudo, foi demonstrado que a RVS em todos os regimes de 12 ou 24 semanas com ou sem VBR foi igual e superior a 95%, incluindo: 95% para 12 semanas de tratamento com SOF/LDV, 97% para 24 semanas de tratamento com SOF/LDV, 96% para 12 semanas de tratamento com SOF/LDV/RBV e 98% para 24 semanas de tratamento com SOF/LDV/RBV. É verdade que a adição de RBV ao SOF/LDV ou o prolongamento do SOF/LDV para 24 semanas pode resultar num ligeiro aumento do SVR12 de 95% para 96%, no entanto, no presente estudo, observou-se que a cirrose (Child-Pugh A) pode afectar (OR = 0,21) o SVR12 apenas em regime de 12 semanas de tratamento com SOF/LDV. Como resultado, nós recomendamos tratar pacientes cirróticos (Child-Pugh A) com SOF/LDV/RBV por 12 semanas ou com SOF/LDV por 24 semanas com base na contra-indicação do RBV e a questão do preço enquanto parece que o tratamento de pacientes não-cirróticos com SOF/LDV por 12 semanas é aceitável. Nesta meta-análise, foi observado o impacto da história prévia do tratamento (além dos regimes baseados em SOF/LDV) no sucesso do tratamento em nenhum dos quatro regimes de SOF/LDV. Como resultado, a seleção da duração do tratamento ou a adição de RBV ao esquema SOF/LDV baseado no histórico de tratamento anterior com PegIFN/RBV ou esquemas contendo IP não é recomendada.
Neste estudo, coletamos os dados para avaliação do impacto dos RASs NS5A basais no sucesso do tratamento, porém em nenhum desses estudos os dados para avaliação da resistência foram estratificados em relação ao esquema de tratamento. Como resultado, os dados para todos os braços de cada estudo foram incluídos nesta meta-análise. Esta meta-análise encontrou os RASs de base do gene NS5A do HCV como um parâmetro que impactou a taxa de resposta ao tratamento. Vale ressaltar que a maioria dos pacientes com falha de tratamento abrigava SARs NS5A no momento da falha do tratamento, o que mostra o papel principal dos SARs NS5A na falha de tratamento de pacientes tratados com LDV.6,7,19-22 Entretanto, a utilidade clínica para avaliação dos SARs NS5A antes de iniciar o tratamento ainda não está definida, talvez devido à alta taxa de resposta ao tratamento para SOF/LDV e à muito baixa especificidade de avaliação dos SARs NS5A para predição de fracasso do tratamento.
A introdução de outros regimes livres de DAAs e IFN e sua aprovação para tratamento de pacientes com infecção pelo genótipo 1 do HCV foi continuada após a aprovação do SOF/LDV. Em dezembro de 2014, foi aprovada a combinação de Ombitas-vir/Paritaprevir-r/Dasabuvir (3 antivirais de ação direta; 3D) para infecção pelo genótipo 1 do HCV com eficácia superior a 95%.23 Em janeiro de 2016, foi aprovada a terapia combinada com Grazoprevir/Elbasvir (GZR/EBR) com cerca de 95% de taxa de SVR.24 Dado que o SOF tem metabolismo renal, este agente antiviral não pode ser administrado em doença renal crônica (clearance de creatinina 2) e o 3D e o GZR/EBR são as alternativas para o tratamento de pacientes com doença renal crônica e infecção pelo genótipo 1 do HCV.25,26 Além disso, outras combinações de DAAs como SOF/Daclatasvir (27) e SOF/ Velpatasvir28 têm estado disponíveis como regimes de tratamento pan-genotípico.
Em conclusão, o tratamento do genótipo 1 do HCV com a combinação SOF/LDV resulta em alta (≥ 95%) resposta ao tratamento. A decisão de adicionar RBV ao SOF/LDV e/ou prolongamento do SOF/LDV pode ser feita com base na presença de cirrose, contra-indicação do RBV e a questão do custo. Mais identificação de pessoas infectadas pelo HCV e maior acesso ao tratamento para elas pode ajudar na eliminação do HCV.29 O próximo objetivo no campo do tratamento do HCV é o desenvolvimento de novos regimes terapêuticos para o HCV sem RBV com uma resposta de tratamento promissora de 100% e sem reação medicamentosa.30
Abrigações
Contribuição dos autores: Conceito e desenho do estudo: Mohammad Saeid Rezaeeee-Zavareh, Bita Behnava, Seyed Moayed Alavian e Heidar Sharafi; aquisição de dados: Mohammad Saeid Rezaeeee-Zavareh e Khashayar Hesa-mizadeh; análise e interpretação de dados: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki e Heidar Sharafi; elaboração do manuscrito: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki e Heidar Sharafi; revisão crítica do manuscrito para conteúdos intelectuais importantes: Bita Behnava e Seyed Moayed Alavian.
Declaração de Interesses Pessoais dos Autores
Nenhum declarado.
Declaração de Interesses Financeiros
Nenhum declarado.
- –
- –
Deixe uma resposta