Assessing Cell Health (Avaliando a Saúde Celular): Viabilidade e Proliferação
On Outubro 11, 2021 by adminParte I: Ensaios de Viabilidade e Proliferação
Viabilidade e Proliferação
Viabilidade e Proliferação são duas características distintas das células. A viabilidade é uma medida do número de células vivas numa população, enquanto a proliferação é uma medida de divisão celular. Deve-se notar que nem todas as células viáveis se dividem. Embora a proliferação possa ser prontamente interpretada como viabilidade, a ausência de proliferação não deve ser automaticamente tomada como sinal de morte celular.
Assessing Viability and Proliferation
1. Permeabilidade da membrana
Uma marca de células mortas e moribundas é a quebra das membranas celular e nuclear. Muitos ensaios de viabilidade usam esta característica de morte celular para distinguir células viáveis de não viáveis.
Polar, manchas de ácido nucléico permeável a células como DAPI, iodeto de propidio (PI) e células mortas com coloração 7-AAD, já que estas manchas podem entrar apenas em células com membranas comprometidas. A PI liga o RNA e o DNA, enquanto o 7-AAD e o DAPI interagem apenas com o DNA. Essas colorações podem ser usadas em combinação com ensaios que detectam atividade enzimática, como os substratos de esterase discutidos na próxima seção, ou com indicadores de viabilidade permeáveis às células para rotular células vivas e mortas simultaneamente. Os ensaios PI, DAPI e 7-AAD podem ser lidos usando um microscópio de fluorescência, citômetro de fluxo (Figura 1), ou leitor de microplaca.
>
A.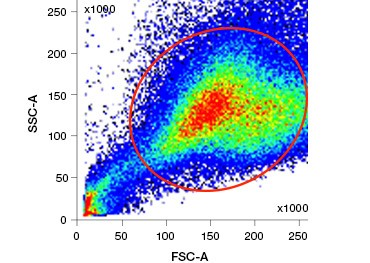
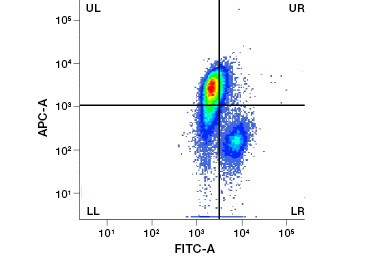
B.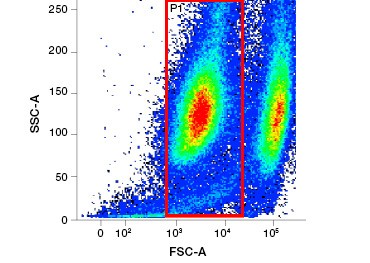
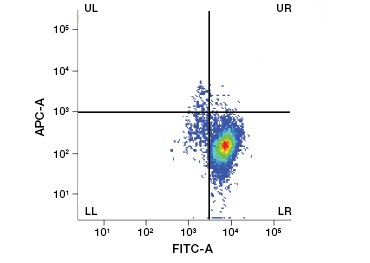
Fig. 1. A coloração de iodeto de propidio melhora a identificação de células de interesse. A coloração de células vivas usando dispersão frontal e lateral pode não ser suficiente para remover células mortas e a ligação não específica pode ainda estar presente (A). O uso de corantes de viabilidade como o iodeto de propidio pode ajudar a eliminar a ligação não específica (B). Os macrófagos J774 foram corados para CD11b e CD3, com o círculo vermelho e o retângulo indicando a estratégia de datação para células vivas.
A marcação é crítica quando se usa estes corantes porque a fração de células coradas aumenta durante a coloração à medida que as células continuam a morrer. Deve-se notar que nenhum destes corantes é fixável. Para aplicações que requerem fixação, monoazidas de etídio ou corantes de proteína amina reativa são uma excelente escolha.
Cell impermeable protein stains are a great alternative to nucleic acid stains, as they are less toxic toxic toxic. Os corantes de aminoácidos reativos vêm em uma ampla gama de espectros de excitação e emissão e, assim, permitem maior flexibilidade no design da citometria de fluxo e painéis de microscopia do que os corantes de DNA. Outra vantagem destas colorações proteicas é que são fixáveis (Figura 2).
A.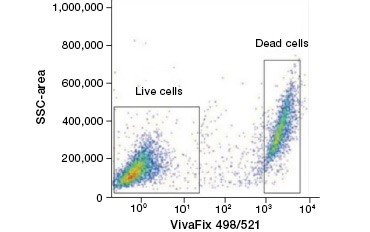
B.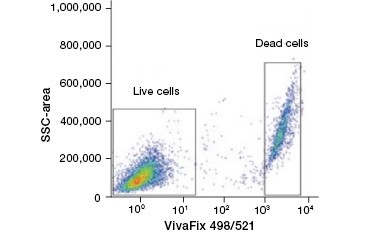
Fig. 2. As manchas de proteína distinguem as células vivas das mortas. Usando VivaFix™ Cell Viability Assays, populações de células vivas e mortas podem ser identificadas e subsequentemente analisadas em células fixas (A) e não fixas (B) usando citometria de fluxo.
Uma consideração especial ao usar a coloração de proteína comum do azul tripano é que este corante irá colorir células viáveis ao longo do tempo de uma maneira específica para a célula. Portanto, é fundamental otimizar os protocolos de azul de tripano para cada tipo de célula e experimento.
Todos estes corantes podem ser usados em células e tecidos individuais e avaliados usando microscopia de fluorescência ou citometria de fluxo, embora a coloração de azul de tripano seja mais comumente avaliada pela contagem manual de células usando um hemocitômetro e microscópio.
Corantes de ácidos nucléicos impermeáveis a células não semelhantes, corantes de ácidos nucléicos permeáveis a células, como o laranja acridina, facilmente difusos através das membranas celulares e, portanto, coram o DNA de células viáveis. As células não viáveis não são coradas de forma eficiente, pois suas membranas comprometidas permitem que o corante se difunda facilmente para fora delas. A laranja acridina é uma coloração de dupla fluorescência que emite fluorescência verde quando ligada ao dsDNA e fluorescência vermelha quando ligada ao ssDNA e ao RNA. Ao usar a laranja acridina como corante de ligação de ADN, tenha em mente que ela não liga a cromatina condensada de forma eficiente. Como discutido na seção 6, este corante também pode ser usado para avaliar a capacidade das células de manter o pH ácido em lisossomos, outro indicador da viabilidade celular. Corantes ácidos nucleicos permeáveis podem ser usados para identificar e quantificar populações celulares viáveis por microscopia, citometria de fluxo, ou ensaio de microplaca.
Corantes impermeáveis e permeáveis a células podem ser usados em combinação com anticorpos fluorescentes contra proteínas de interesse, tornando simples a inclusão de controles cruciais de viabilidade em cada experimento. Uma consideração fundamental ao usar estes corantes para avaliar a integridade da membrana é que diferentes tipos de células têm diferentes características de permeabilidade da membrana. Por exemplo, algumas manchas de DNA impermeável a células irão prontamente corar células eucarióticas mortas, mas são incapazes de coraricariote com membranas comprometidas.
A integridade da membrana também pode ser avaliada usando ensaios enzimáticos. Uma escolha popular é avaliar o vazamento da enzima citoplasmática desidrogenase láctica (LDH) para o meio de cultura na morte celular. Os ensaios colorimétricos LDH podem ser realizados em formato de microplaca e lidos usando um leitor de microplaca ELISA.
A desintegração da membrana também pode ser medida usando ensaios de liberação de cromo. Aqui as células são pré-rotuladas com 51Cr antes do tratamento experimental. O cromo liga-se às proteínas celulares e é liberado no meio de cultura após a morte da célula. Ao determinar a quantidade de 51Cr livre versus 51Cr ligado, usando um contador de cintilação, a morte celular pode ser medida quantitativamente. As células também podem ser pré-rotuladas com corantes fluorescentes. Estes métodos às vezes sofrem de fundo elevado devido à libertação espontânea de etiquetas; são úteis apenas para aplicações que permitem a pré-rotulagem de células de interesse.
2. Actividade enzimática
Outra distinção chave entre células viáveis e não viáveis é que as células viáveis são enzimaticamente activas. A atividade esterase, medida usando substratos como o diacetato de carboxifluoresceína (CFDA), é comumente usada como um indicador da atividade enzimática global. O CFDA é um corante não fluorescente, permeável às células, que é hidrolisado para formar a molécula fluorescente carboxifluoresceína por esterases intracelulares não específicas presentes apenas nas células viáveis. Como a carboxifluoresceína é carregada negativamente, ela é retida de forma não-verbal em células viáveis, resultando em fluorescência verde.
CFDA-SE é uma derivada do CFDA que é melhor retida na hidrólise. Seu produto, CFSE, possui grupos de ésteres succinimidílicos que formam ligações covalentes com aminas primárias de proteínas intracelulares, permitindo o rastreamento da viabilidade celular a longo prazo. Como a CFSE é covalentemente retida nas células, é um indicador mais confiável de viabilidade celular e uma medida popular de proliferação celular, pois sua fluorescência é reduzida pela metade com cada divisão celular (Figura 3). Melhorias na CFDA-SE foram feitas com corantes de proliferação que têm maior retenção celular, proporcionam maior resolução de divisão celular e estão disponíveis em uma ampla gama de espectros de excitação e emissão para permitir a incorporação em aplicações fluorescentes multicoloridas como citometria de fluxo.
A.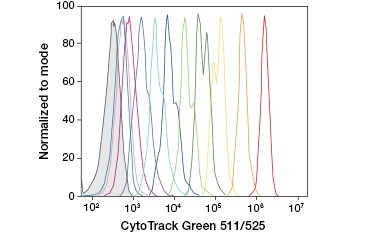
B.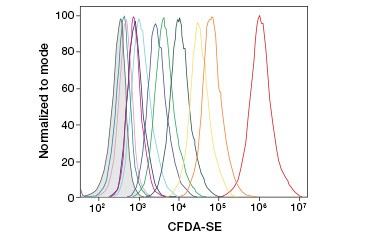
Fig. 3. Rastreamento de gerações de células por citometria de fluxo. Dez gerações de células podem ser resolvidas usando CytoTrack™ Green 511/525 Cell Proliferation Assay (A) e até oito usando CFDA-SE (B).
Muitos outros substratos de esterase fluorescente, tais como derivados de calceína e BCECF, estão disponíveis com propriedades variáveis, incluindo diferenças nos espectros de excitação/emissão. Como a fluorescência do BCECF é sensível ao pH, também pode rastrear alterações no pH citosólico.
Utilizando substratos de esterase permeáveis às células, a viabilidade pode ser avaliada por microscopia de fluorescência e citometria de fluxo. Estes substratos também podem ser aplicados em amostras de tecidos ou usados em ensaios de microplacas de alto rendimento.
3. Atividade metabólica
Outra medida comum de viabilidade celular é a atividade metabólica, que pode ser avaliada usando sondas oxidáveis e redutíveis.
Resazurina é um indicador popular de oxidação-redução (redox). Este corante permeável às células pode ser adicionado diretamente aos meios de cultura celular, tornando-o um ensaio rápido e conveniente. Nas células metabolicamente activas, a resazurina azul e fracamente fluorescente é reduzida para formar a resorufina, uma molécula rosa e altamente fluorescente. Esta alteração pode ser monitorizada utilizando tanto os ensaios fluorescentes como colorimétricos. Como a quantidade de fluorescência é diretamente proporcional ao número de células vivas e respiratórias, a resazurina é amplamente utilizada para medir quantitativamente a viabilidade celular. A resazurina é uma alternativa conveniente, mais sensível e estável e não tóxica a outros indicadores redox, como os sais de tetrazólio MTT e XTT. Ao contrário dos ensaios baseados em sais de tetrazólio, que são colorimétricos e só podem ser lidos usando um leitor de microplacas, os ensaios de viabilidade da resazurina podem ser lidos usando citometria de fluxo ou microscopia de fluorescência. Os sais de resazurina e tetrazólio são particularmente úteis para aplicações de alto rendimento porque a viabilidade pode ser avaliada em microplacas usando um leitor de microplacas (Figura 4). O XTT é frequentemente escolhido em vez do MTT para aplicações de maior rendimento porque, ao contrário do MTT, produz um corante solúvel em água, eliminando assim uma etapa de solubilização que é crucial para os ensaios de MTT. Os sais de resazurina e tetrazólio são mais comumente usados para avaliar a viabilidade de células aderentes e células em solução.
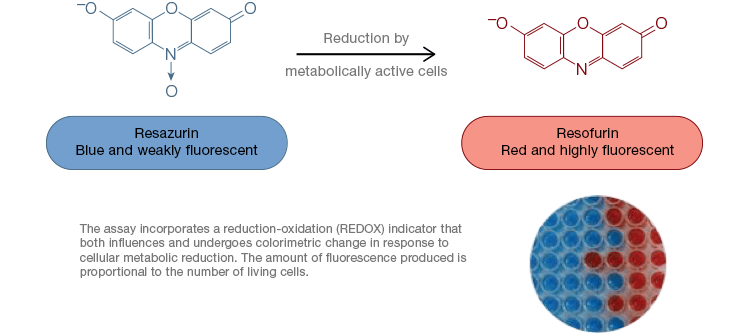
Fig. 4. Os ensaios de oxidação não tóxica da resazurina são facilmente escaláveis para aplicações de alto rendimento. A oxidação do alamarBlue em células metabolicamente ativas resulta em uma mudança colorimétrica de azul para vermelho, bem como um aumento da fluorescência.
Dihidrodrohodaminas, -calceínas, e -fluoresceínas são redução-rhodamina, -calceína, e -fluoresceínas derivadas que são células-permeáveis e incolorescentes. Estes compostos são prontamente oxidados ao seu corante-mãe fluorescente por espécies reativas de oxigênio presentes nas células e tecidos vivos.
Outras classes de ensaios de viabilidade que medem a atividade metabólica são os ensaios ATP luminescentes. Estes quantificam o ATP liberado pelas células sobre lise. Eles não requerem longos períodos de incubação, são extremamente sensíveis e são normalmente lidos usando um leitor de microplacas.
Um fator a ser considerado ao usar ensaios que medem a atividade metabólica é que a atividade metabólica pode diferir sob diferentes condições de cultura de células. Portanto, é necessário incluir controles adequados para contabilizar essas diferenças.
4. A síntese/replicação de DNA
Outra medida de viabilidade, e um método popular de avaliação da proliferação, é a quantificação da incorporação da BrdU no DNA recém-sintetizado. O DNA contendo BrdU é identificado usando anticorpos conjugados BrdU ou anticorpos BrdU em combinação com um anticorpo secundário conjugado (Figura 5). Estes ensaios permitem uma variedade de leituras, uma vez que os anticorpos podem ser acoplados a diferentes tipos de indicadores (fluoróforos, peroxidases, etc.). A marcação de anticorpos de marcadores celulares específicos também permite distinguir populações específicas proliferantes. As amostras são fixadas pós-incubação e depois analisadas usando citometria de fluxo, microscopia de fluorescência, imunohistoquímica, ou leitores de microplacas. Usando a citometria de fluxo, as células podem ser atribuídas à fase G0/G1, S, ou G2/M do ciclo celular com base no seu conteúdo total de DNA. O uso de substratos cromogênicos de peroxidase permite que os ensaios sejam lidos sem um fluorômetro. E usando -TdR ao invés de BrdU estes ensaios podem ser convertidos para uma leitura radiolabel.
A.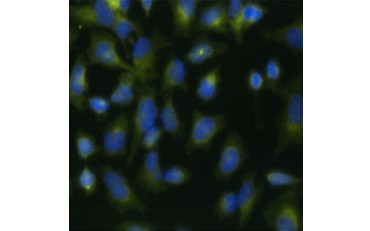
B.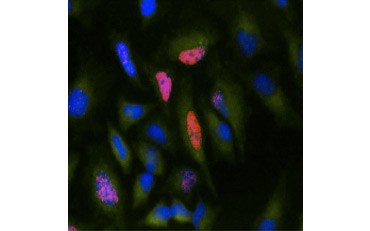
Fig. 5. Visualização da incorporação da BrdU. As células HeLa foram tratadas com 10 µg de BrdU durante 1 h (B) ou deixadas sem tratamento (A). As células foram coradas com anticorpo Mouse Anti-BrdU, clone Bu20a (MCA2483; diluição 1:25) e Goat Anti-Mouse IgG (H/L) DyLight 549 Conjugated Antibody (red) (STAR117D549GA; diluição 1:50) foi usado como um anticorpo secundário. O citoplasma foi corado com Anticorpo Anti-GAPDH Coelho (AHP1628; diluição 1:100) e Anticorpo Conjugado IgG DyLight 488 (verde) (STAR36D488GA; diluição 1:50) foi usado como um anticorpo secundário. PureBlu™ DAPI (1351303) foi usado como contra-mancha nuclear.
5. Expressão do marcador de proliferação
Proteínas certas são conhecidas por aumentarem de expressão durante a proliferação celular. Ki-67, por exemplo, é expresso no núcleo das células divisoras, mas não é detectável durante G0 e G1 (Figura 6). Da mesma forma, a fosforilação histone H3 pode ser usada para identificar células na fase M. Outros marcadores de proliferação comumente usados incluem o antígeno nuclear celular proliferante (PCNA) e a manutenção dos minicromossomos 2 (MCM2). Usando anticorpos contra estes, outros marcadores chave de proliferação ou marcadores de linhagem celular podem ser avaliados usando ELISA, citometria de fluxo, imunohistoquímica, microscopia de fluorescência, e Western blotting.
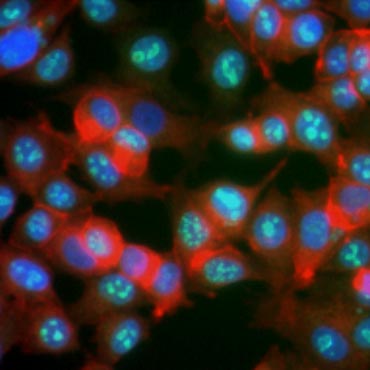
Fig. 6. Anticorpos contra Ki-67 identificam células proliferantes. Coloração de células MCF-7 com anti Ki-67 humano (HCA006, verde) contra-mancha com falloidina (vermelho) e Hoechst (azul).
6. Potencial de membrana e pH
Células vivas mantêm ativamente gradientes de íons através de suas membranas, gerando potenciais transmembranas. Quando uma célula morre, esses gradientes de íons são perturbados. Isto pode ser avaliado usando corantes potenciométricos. JC-1 é um corante potenciométrico comumente usado. Nas células saudáveis, o JC-1 localiza-se nas mitocôndrias, onde forma agregados fluorescentes vermelhos. Após a quebra do potencial da membrana mitocondrial, o JC-1 se difunde por toda a célula e existe como um monômero fluorescente verde. Os ésteres etílicos de tetrametil-rhodamina (TMRE) e os ésteres metílicos de tetrametil-rhodamina (TMRM) como o JC-1 localizam-se nas mitocôndrias em células saudáveis e no citoplasma em células moribundas. Ao contrário do JC-1, estes corantes não apresentam uma mudança nos seus espectros de emissão. Em vez disso, a permeabilização da membrana externa mitocondrial resulta numa diminuição da fluorescência vermelha TMRM/TMRE.
Células viáveis são capazes de gerar e manter um pH baixo nas organelas ácidas da célula, tais como o lisossoma. Isto pode ser medido usando manchas acidotropicas como o laranja acridina e o vermelho neutro. Uma consideração ao utilizar o corante acridina laranja é que este corante também liga DNA e RNA. Quando ligado a nucleotídeos de fio simples, a laranja acridina fluoresce em vermelho; quando ligado a ADN de fio duplo, fluoresce em verde; e quando ligado a ADN no lisossoma, fluoresce em laranja.
Independentemente do método escolhido, é extremamente importante incluir controlos apropriados quando se realiza qualquer um dos ensaios aqui descritos, uma vez que as condições experimentais e o tipo de célula podem alterar o desempenho de alguns ensaios. Inclua sempre controles positivos e negativos. Ao utilizar sondas em solventes, incluir também controlos tratados com veículos para contabilizar os efeitos do solvente. Use controles específicos da aplicação para controlar fatores como autofluorescência em experimentos de imunofluorescência e citometria de fluxo e controles de carga para Western blotting.
Para informações sobre os ensaios de viabilidade e proliferação celular do Bio-Rad, visite nossa página de saúde celular.
Leia a Parte II Avaliando a Saúde Celular: Apoptose
alamarBlue é uma marca registrada da Trek Diagnostic Systems. DyLight é uma marca registrada da Thermo Fisher Scientific.
Deixe uma resposta